Objectif : vérifier une technique simple de stérilisation à destination de l'élimination de levures génétiquement transformées en laboratoire.
- Mise en oeuvre d'une procédure de réduction de charge microbienne ;
- Calcul du temps de réduction décimal pour une température donnée
Les techniques de réduction de charge microbiennes sont nombreuses et utilisées dans les domaines de l’agro-alimentaire, des cosmétiques, de la pharmaceutique, ou de la santé.Pour juger de l’efficacité des traitements thermiques que sont la pasteurisation et la stérilisation, on utilise la courbe de destruction thermique des micro-organismes cN(microorganisme ; milieu étudié) = f(t) qui suit une loi mathématique de type exponentielle.
Une représentation semi-logarithmique de cette courbe permet sa linéarisation utile à la détermination du paramètre de thermorésistante Dθ : ce paramètre, appelé temps de réduction décimal, permet d’évaluer l’efficacité d’un traitement thermique sur une souche bactérienne ou fongique donnée
1ère partie : vérification de l'efficacité d'une procédure d'autoclavage sur une suspension de levures Saccharomycèes cerevisieae
- À partir d'une suspension de levures notée L (A CONSERVER DANS LA GLACE)
- Réaliser un étalement au râteau de 0,1 mL sur gélose Sabouraud
- Réaliser un frottis fixé coloré au bleu de méthylène. Observer .
- À partir d'une suspension de levures après autoclavage notée Lac.
- Réaliser un étalement au râteau de 0,1 mL sur gélose Sabouraud
- Réaliser un frottis fixé coloré au bleu de méthylène. Observer
- Donner une définition des levures.
- Préciser leur place dans la classification des micro-organismes.
- Comparer la suspension de levure avant/après autoclavage (aspect microscopique, aspect de l'étalement et dénombrement si possible)
- Rappeler les conditions utilisées (couple température/durée) pour l'autoclavage
- Conclure sur l'efficacité de l'autoclavage.
2ème partie : mise en oeuvre de la réduction de charge microbienne et dénombrement des cellules vivantes après traitement thermique
cf. AT de 1ère pour les détails
Objectif : réaliser de façon collaborative (équipe de 8 élèves) une cinétique de destruction d'un micro-organisme (Saccharomyces cerevisiae) avec deux traitements thermiques stabilisés différents afin de déterminer et comparer le temps de réduction décimal pour chaque température, et calculer le temps nécessaire à la destruction totale d'une population microbienne (connaissant sa concentration en nombre).
Les paramètres et conditions de mises en oeuvre :
-Traitement thermique à 50 °C ou 60 °C (bains thermostatés)
-Durée de traitement thermique : 0, 3, 6, 0, 12 et 15 min.
-Dénombrement par cytométrie directe après coloration vitale au bleu de Funk.
La répartition du travail : deux équipes de 8 élèves
-Six manipulateurs, chacun réalisant une durée de traitement thermique, un comptage en hématimètre, les calculs de pourcentage de levures vivantes et mortes et les calculs de concentration en nombre de levure vivantes.
-Deux superviseurs/rapporteurs, chargés de répartir et coordonner le travail, valider la bonne exécution des gestes techniques et des comptages, rédiger un tableur complet de valeurs regroupant les valeurs obtenues par chaque manipulateur.
- Cytométrie directe avant traitement thermique (manipulateur 1)
- Préparer une dilution de la suspension L au ½ dans du bleu de Funk dans un volume final de 200 µL.
- Homogénéiser. Laisser agir 1 à 2 minutes.
- Remplir la chambre hématimétrique (hématimètre de Malassez). Laisser sédimenter 5 minutes avant de réaliser le comptage.
- Dénombrer les cellules vivantes et mortes sur 4 rectangles (unités) de comptage
- le total des cellules comptées doit être supérieur ou égal à 200 ;
- si le total est inférieur à 200, utiliser davantage de rectangles de comptage)
- si il y a plus de 50 levures par rectangle, procéder à une dilution adaptée.
- Mise en œuvre d'un traitement thermique en bain thermostaté (manipulateurs 2, 3, 4, 5 et 6)
- Régler le bain thermostaté à la température de travail. Vérifier au thermomètre à alcool ou électronique (Rappel l'affichage incorporé à un instrument n'est pas forcément fiable : utiiser un instrument correctement étalonné pour les mesures de température)
- Introduire 0,5 mL de la suspension de levure dans un tube à hémolyse en verre
- Incuber à la température de travail chaque tube selon la durée suivante (respecter impérativement la durée de traitement
|
2 min
|
4 min
|
6 min
|
8 min
|
10 min
|
12 min
|
14 min
|
16 min
|
- Transférer immédiatement dans la glace après le temps de traitement thermique afin de stopper l’effet de la chaleur (ce qui fausserait le comptage)
- Cytométrie directe après traitement thermique
- Pour chaque durée de traitement thermique, procéder à un dénombrement comme dans la partie A.
- Justifier la nécessité de conserver les suspensions dans la glace :
- durant la manipulation ;
- immédiatement après le traitement thermique.
- Présenter le comptage des cellules (vivantes, mortes) avant le traitement thermique.
- Calculer (chaque calcul étant justifié par l'équation aux grandeurs et aux unités)
- la concentration en nombre CN(levures vivantes ; suspension avant autoclavage) en levures·mL-1
- le pourcentage de viabilité.
- Présenter sous forme de tableau (tableur-grapheur) :
- le nombre total de levures vivantes dans les 4 rectangles de comptages
- la concentration en nombre CN(levures vivantes ; suspension avant autoclavage) en levures·mL-1 en effectuant les calculs dans les cellules du tableur)
- le logarithme décimal de la concentration en nombre de levures (en effectuant les calculs dans les cellules du tableur)
- le facteur de réduction de la population (par rapport à la concentration initiale).
- A l’aide du tableur, créer un graphe montrant simultanément :
- le nuage de points : CN(levures vivantes ; suspension) = f(temps)
- le nuage de points : LogCN(levures vivantes ; suspension) = f(temps) (une droite devrait être obtenue)
- Déterminer le temps de réduction décimal Dθ qui correspond au temps nécessaire pour tuer 90 % des micro-organismes d’une population dans un échantillon à une témpérature spécifique, ce qui correspond à une réduction d’un facteur 10 de CN soit une unité Log(CN) la population microbienne.
- Comparer les graphes et valeurs obtenues pour chaque température de travail.
Exemple de tableur rédigé par les superviseurs d'une équipe :
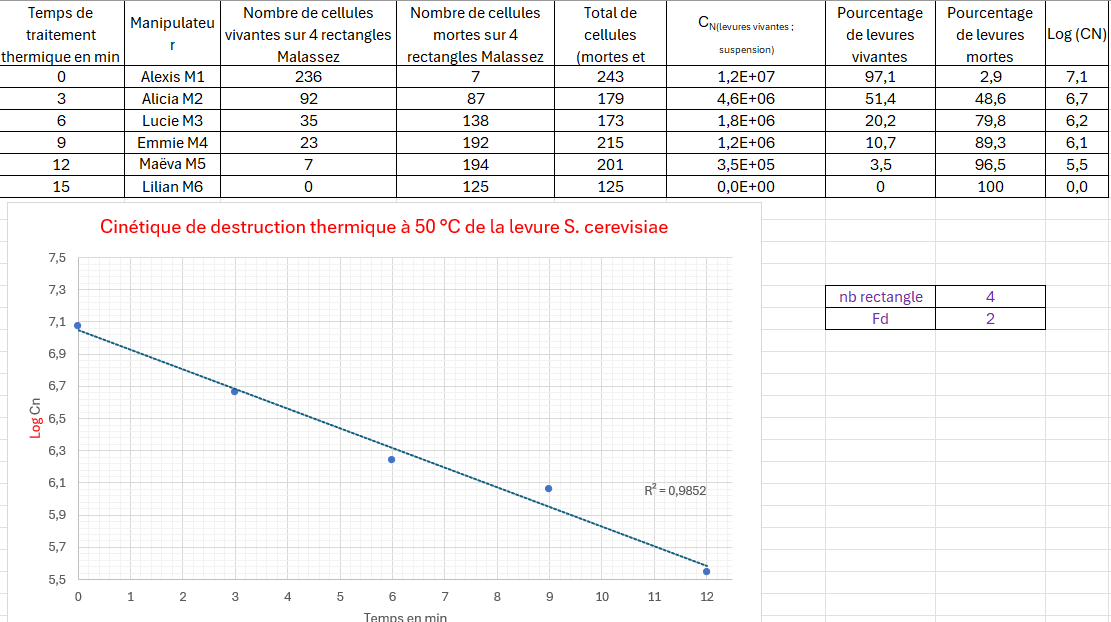
A l'aide de cette courbe, déterminer graphiquement le temps de réduction décimale Dθ qui permet d’évaluer l’efficacité d’un traitement thermique sur une souche bactérienne ou fongique donnée.
Exploitation (sur une autre série de valeurs expérimentales)
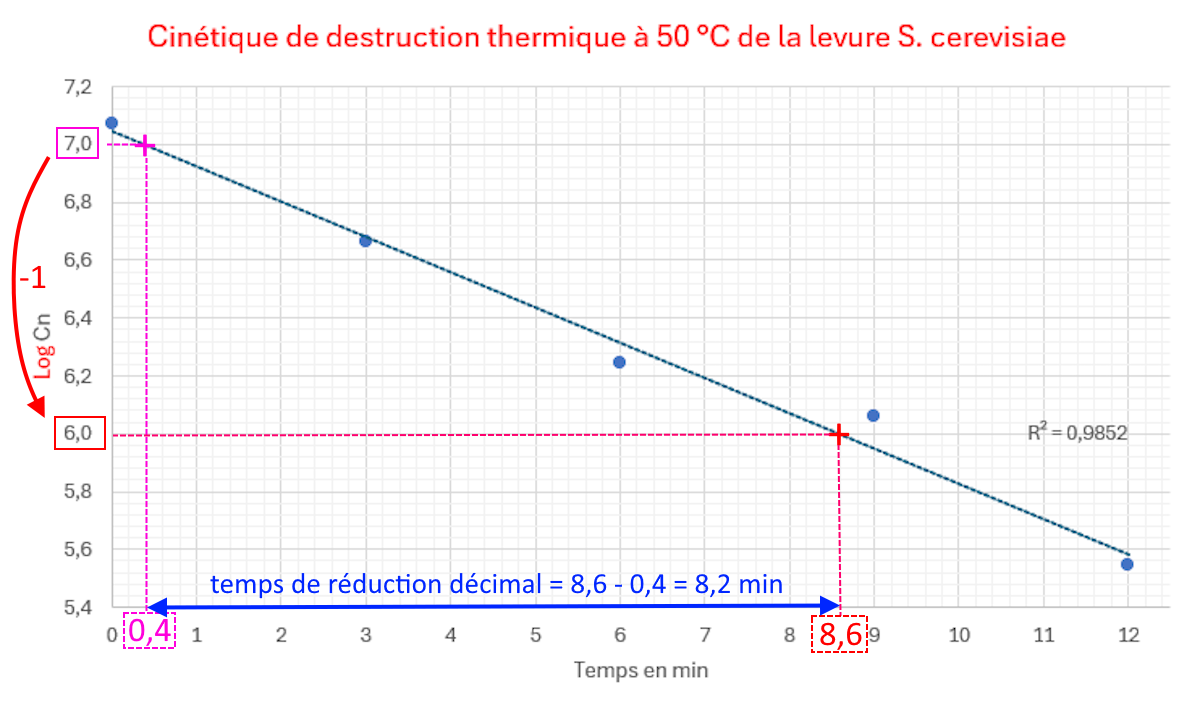 Rappel : le temps de réduction décimal (différentes définitions)
Rappel : le temps de réduction décimal (différentes définitions)
1) est le temps permettant de réduire de 90 % la concentration en nombre d'une population
2) est le temps nécessaire pour ne laisser que 10 % de survivants d'une population
3) est le temps permettant de réduire d'un facteur 10 la concentration en nombre d'une population
4) est le temps permettant de réduire d'une unité log la concentration en nombre d'une population
3ème partie : comparaison de l'efficacité de deux désinfectants
Il s'agit de réaliser l'étude comparée de l'efficacité de l'eau de Javel et du produit Amphospray ® (un mélange) détergent/désinfectant) sur une bactérie-test.
|
Postes
|
Pairs
|
|
Agent microbien
|
Serratia marcescens
|
|
Agent antimicrobien
|
Eau de Javel 3 % (V/V)
|
|
Postes
|
Impairs
|
|
Agent microbien
|
Serratia marcescens
|
|
Agent antimicrobien
|
Détergent/désinfectant Amphospray ® à 5 %
|
En utilisant une ligne d'une microplaque par élève (une plaque par binôme) réaliser la procédure suivante :
|
Puits
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
|
Bouillon MH (µL)
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
Eau de Javel ou Amphospray (µL)
|
0
|
100
|
100
|
|
|
|
|
|
|
|
|
|
|
Redistribuer Javel ou détergent (µL)
|
/
|
/
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
Inoculum (µ)L
|
100
|
0
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
- Un seul cône stérile pour distribuer le bouillon MH dans tous les puits.
- Puits 2 : jeter le cône après homogénéisation par aspiration-refoulement.
- Puits 3 à 12 : homogénéiser en évitant la formation de bulles puis changer de cône.
- Ajout de l'inoculum : en partant du puits 12, SAUF le puits 2
- Recouvrir les lignes utilisées de la microplaque avec du Parafilm®.
- Mettre les microplaques sous agitation douce à l'aide de l'agitateur orbital, 36 h RT.
Exemple de résultats obtenus :

- Argumenter sur le rôle des puits 1 et 2.
- Analyser après incubation les puits 1 et 2. Conclure.
- Rédiger un tableau de résultats comprenant :
- le % de chaque agent antibactérien pour chaque puits (calcul exigé pour tube 3)
- la présence (+) ou absence (-) de trouble après incubation.
- En déduire le pourcentage minimal inhibiteur (PMI) de chaque agent microbien pour chaque micro-organisme testé. Justifier la réponse.
- Comparer les PMI et déterminer quel est l'agent antimicrobien le plus efficace, la souche la plus sensible (et la plus résistante) à la Javel et au détergent/désinfectant.