Objectif : inclure en enzyme, préalablement extraite et caractérisée (la peroxydase de légumes) dans des billes d'alginate pour montrer expérimentalement la ré-utilisation d'une enzyme après une premiere série de réactions.
Les enzymes sont des outils de prédilections en biotechnologies : enzymes de restriction on biologie moléculaire, enzyme système révélateur dans les kits de dosage et diagnostic… Si certaines sont faciles à extraire et utiliser, d’autres nécessitent de longues étapes de purification et s’avèrent de fait coûteuses à l’achat.
Aussi serait-il particulièrement intéressant de pouvoir réutiliser une enzyme (si tant est qu’elle soit réutilisable !) qui a déjà servi pour faire un dosage ou une recherche de biomolécule.
Extraire des enzymes comme les peroxydases peut se faire à très bon marché, en utilisant des légumes comme le raifort, les radis (roses, noirs, blancs) ou les navets, comme réalisés dans l'activité idoïne.
Après avoir déterminé les vitesses de transformation et l'activité enzymatique totale et spécifique, les objectifs sont les suivants :
-vérifier si l'assertion "un enzyme se retrouve intacte en fin de réaction et peut donc êtr réutilisée" est avérée ;
-mettre en oeuvre une procédure permettant de réutiliser une enzyme
-et si possible déterminer la température optimale d'activité de la peroxydase extraite d'un des légumes précédemmen utilisé.
Pour ce faire, la technique mise en oeuvre est l'immobilisation de l'enzyme à l'intérieur de billes d'alginate (lien vers un pdf donnant plus d'explications).
Remarque : l'aglinate est aussi utilisé comme additif alimentaire (E401), notamment dans les boissons ; il améliore leur texture en éliminant les protéines indésirables et est utilisé comme émulsifiant et gélifiant.
Préparation de la solution d'alginate à 1 % (m/V) à partir de poudre d'acide alginique
Réactifs et matériel
- Solution d’enzyme prête à l’emploi
- 25 mL de solution de chlorure de calcium CaCl à 150 mmol·L-1
- Poudre d’acide alginique
- Pipettes à disposition : graduées, à piston, jaugées…
- Petit matériel courant : papier filtre, pipette compte-gouttes souple, bac à glace, tube à hémolyse, portoir, bécher en verre de 50 mL, boîte de Pétri, vortex, filtre en nylon + élastique
- Matériel en commun : centrifugeuse pour tubes à hémolyse réfrigérée à 4 °C
Réalisation
- Chauffer environ 75 mL d’eau distillée dans un bécher. À ébullition débutante, arrêter le chauffage (ou chauffer en bouilloire et prélever 75 mL)
- Verser en pluie dans l’eau chaude, par petites fractions, 1 g d’acide alginique tout en agitant avec un agitateur (canne de verre) pendant au moins 5 minutes pour éviter les grumeaux.
- Après dissolution, ajuster le volume à environ 100 mL avec de l’eau distillée.
- Centrifuger 5 minutes environ 10 mL de solution à 2 500 tpm pour chasser les bulles d’air

Aucune difficulté particulière. Après une pesée d'une masse malginate permettant de préparer 100 mL d'une solution à 1% (m/V), il faut dissoudre la poudre d'acide alginique dans de l'eau en veillant à l'incorporer progressivement sous agitation énergique. En cas de grumeaux, les écraser avec le dos de la spatule et mélanger jusqu'à obtenir la dissolution totale.
Préparation du mélange solution d'alginate + peroxydase
- Dans un tube à centrifuger préalablement étiqueté, introduire :
- 2 mL de solution d’alginate à 1 % (m/V) pré-incubé pendant 2 minutes dans la glace ;
- 500 µL de solution enzymatique ;
- Vortexer.
- Centrifuger 5 minutes le mélange à 2 500 tpm pour chasser les bulles d’air.
- Conserver dans la glace.
Fabrication des billes d'alginate +incluant la peroxydase
Les billes d'alginate sont formées en faisant tomber des gouttes de mélange (alginate/POD) dans une solution de chlorure de calcium.
- Verser les 25 mL de solution de CaCl2 à 0,5 % (m/V) dans un bécher de 50 mL en verre.
- Aspirer la totalité du mélange alginate-enzyme dans une pipette compte-gouttes souple, sans aspirer d’air.
- Laisser tomber les billes, goutte à goutte, dans la solution de CaCl2.
- Une fois les billes devenues opaques, les récupérer en plaçant une gaze disposée sur le haut d’un bécher de 50 mL : fixer la gaze avec un élastique, puis éliminer la solution de CaCl2 par dans l'évier.
- Rincer les billes trois fois avec 50 mL d’eau distillée, puis les laisser sécher sur un papier filtre légèrement humidifié dans une boîte de Pétri, maintenue dans la glace.

Cette sphérification permet d'emprisonner un liquide (ici la solution d'extrait enzymatique de peroxydase de radis noir) dans une sphère gélifiée.
La solution de chlorure de calcium crée une couche gélifiée qui s'épaissit vers l’intérieur.
Ces sphères sont toutefois instables dans le temps, et une perte d'enzyme aura donc lieu par de simples phénomènes de diffusion.
Dosage de l’activité de la peroxydase par méthode cinétique continue
Réactifs et matériel
- Billes d’alginate préalablement préparées incluant l'enzyme
- Tubes à hémolyse, portoir, flotteur
- 2 semi-microcuves de 1 mL
- Solution de substrat de l'enzyme (gaïacol et non pNPP, merci au lecteur avisé qui a relevé la coquille ! )
- Pipette à piston P 1000 et cônes adaptés
- Chronographes
- Bain thermostaté à différentes températures : trois températures seront testées : 20 °C, 30 °C et 40 °C.
Chaque température sera testée par deux trinômes différents afin d’évaluer la reproductiblité de la méthode.
Réalisation
- Ajuster le spectrophotomètre, réglé sur la longueur d'onde de travail, à zéro sur la solution de substrat.
- Dans un tube à hémolyse, verser 5 mL de solution étalon de substrat.
- Pré-incuber la solution de substrat pendant deux minutes à la température à tester.
- Déclencher la réaction en ajoutant 10 billes d’alginate incluant l'enzyme.
- Homogénéiser immédiatement, délicatement et régulièrement par retournement avec le Parafilm®.
- Faire un prélèvement de 1 mL de la phase liquide toutes les …….. s pendant 4 minutes, et transférer dans une semi microcuve de 1 mL.
- Lire le plus rapidement possible l’absorbance à 405 nm contre le blanc réactif.
- Reverser immédiatement la totalité du prélèvement après chaque lecture dans le tube à hémolyse maintenu à ……. °C è le volume du bioréacteur utilisé doit rester constant.
- Une fois les indications d’absorbances relevées :
- récupérer délicatement (filtration sur papier) les 10 billes et jeter le liquide ;
- rincer très délicatement les billes avec de l’eau distillée ;
- recommencer la manipulation avec 5 mL de solution de substrat neuf.
Photo des billes après un premier cycle d'utilisation : on constate qu'elles sont conservée la couleur du produit chromophore et ce même après rinçage, indiquant qu'une partie du produit formé est resté emprisonné dans la bille.

Remarque : une variante de fabrication des billes peut être réalisée : la sphérification inversée. Dans cette variante, la solution enzymatique à tester est mélangée non pas à la solution d'alginate, mais dans la solution de chlorure de calcium. Ce mélange est ensuite versé au goutte à goutte dans la solution d'alginate ; celui-ci se gélifie alors instantanément autour de la goutte de mélage (chlorure de calcium/enzyme), qui se retrouve donc emprisonnée au sein d'une couche d'alginate gélifiée.
Voici un schéma (lien de la source) présentant cette variante :
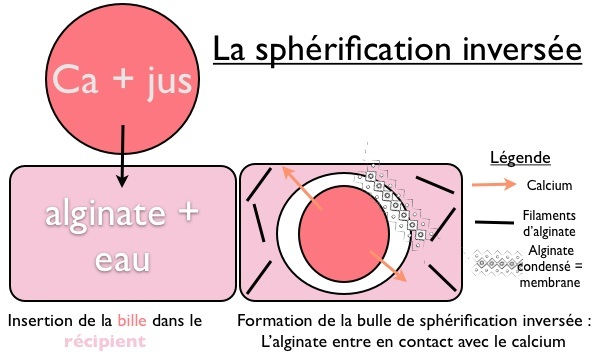
Ces techniques sont celles utilisées dans les techniques de cuisine moléculaire !
Analyse des valeurs mesurées : détermination de l’activité de la POD de radis noir après immobilisation par inclusion en billes d’alginate à 30°C

1er cycle : une phase de latence qui correspond vraisemblablement au temps nécessaire à la diffusion du substrat à l’intérieur de la bille (dont le cœur liquide emprisonne l’enzyme).
Ensuite la réaction a lieu à vitesse constante et maximale (début de la période initiale à t = 70 secondes).
Les 3 dernières valeurs peuvent s’expliquer par une homogénéisation insuffisante du milieu réactionnel.
2ème cycle : une phase de latence plus longue, pouvant s’expliquant par le fait que du produit a pu rester emprisonné dans les billes. Ensuite la réaction se déroule à vitesse maximale et constante, et la pente semble être la même que lors du 1er cycle. Il faut donc les calculer et les comparer.
Coefficients directeurs ΔA/Δt :
- Cycle 1 : ΔA/Δt = (1,2 – 0,2) / (150-70) = 0,0125 s-1
- Cycle 2 : ΔA/Δt = (1,3 – 0,35) / (210-150) = 0,0158 s-1
On peut constater que les deux valeurs de pentes sont très proches.
Conclusion : cette technique d'immobilisation permet de prouver expérimentalement que les enzymes se retrouvent intactes en fin de réaction et sont donc réutilisables.
En effet, ce sont les mêmes billes qui ont été utilisées lors des deux cycles, aucun nouvel apport d'enzyme n'a été effectué.
Détermination de l’activité de la POD de radis noir après immobilisation par inclusion en billes d’alginate à différentes températures
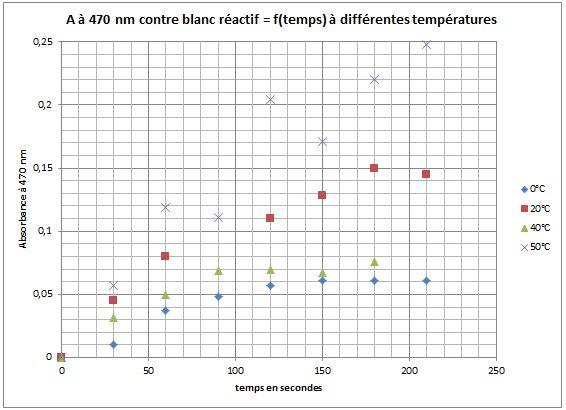
- Que peut-on constater ?
- Les courbes ont globalement le même aspect : on peut déterminer la période initiale pour chaque température, elles sont globalement proches.
- Les valeurs pour le 1er cycle à 30 °C n’ont pas été placées sur ce graphe car les absorbances mesurées sont bien plus importantes (1,3 contre 0,25 pour la valeur la plus élevée).
Les courbes pour les autres températures auraient été "aplaties" par l'échelle. Ceci permet donc immédiatement de déterminer la température optimale de travail de cette enzyme.
- La pente la plus faible est obtenue à 0 °C ; toutefois l’activité de la peroxydase n’est pas nulle.
- La vitesse de réaction augmente pour 20 °C, est maximale pour 30°C, diminue pour 40°C mais augmente à nouveau pour 50 °C !
Ceci peut s’expliquer qu’à cette température, les phénomènes de diffusion de molécules (substrat notamment) sont bien plus importants et davantage de substrat est apporté à l’enzyme ; par ailleurs, le groupe ayant travaillé à cette température a pu constater que les billes étaient devenues très fragiles et s’étaient, pour la moitié d’entre elles, déchirées après le premier cycle.
- La calcul des pentes en période initiale permettrait de tracer un graphe secondaire : pente = f(température).