Objectif : séparer les principales molécules composant le lait en utilisant la méthode de chromatographie d’exclusion puis de les identifier par des tests qualitatifs
La séparation des composants du lait est souvent nécessaire pour réaliser des préparations entrant dans l’alimentation humaine, en particulier la séparation des protéines ou des lipides : fromages, crème et beurre. Il en résulte des déchets comme le lactosérum et le babeurre (petites protéines, lactose, vitamines) qui sont valorisés : compléments alimentaires dans l’alimentation humaine et animale, compost.
Le lait le plus utilisé pour l’alimentation est le lait de vache :
Les différents constituants du lait peuvent être séparés selon la taille ou la masse, la charge électrique des molécules ou leur solubilité dans des solvants organiques ou à forte teneur en ions.
Les techniques qui utilisent le critère de taille ou de masse pour séparer les molécules sont :
- la chromatographie de filtration sur gel ou chromatographie d’exclusion ou perméation de gel ;
- la filtration sur membrane ;
- la dialyse ;
- la centrifugation
La chromatographie présente des avantages car elle peut être :
- analytique : elle permet simplement de séparer les composantes de l'échantillon afin de fournir une analyse qualitative ou semi-quantitative de l'échantillon ;
- préparative : elle permet alors, après séparation, de récupérer (purification) des quantités suffisantes d'un composant spécifique de l'échantillon.
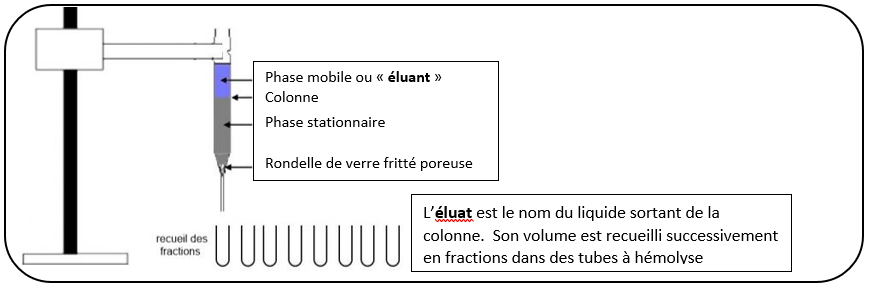
Procédure opératoire de la chromatographie de gel-filtration du lait
Moyens et dispositif expérimental
- Colonne de chromatographie fermée par un robinet
- Gel Séphadex G25 hydraté et lavé, coulé dans la colonne
- Eau déminéralisée (éluant)
- Une série de tubes à hémolyses numérotés de 1 à 10 et jaugés à 2 mL, en portoir
- Pipettes à piston P1000 et cônes bleus
- Lait à analyser

Attention : le gel ne doit jamais être déshydraté sous peine de dysfonctionnement
Préparation de la colonne
-Retirer les parafilms, placer un bécher poubelle en sortie de colonne.
-Ouvrir le robinet de la colonne et laisser s’abaisser le niveau du liquide jusqu’à ce qu’il affleure la surface du gel ; fermer alors le robinet de la colonne.
Dépôt du lait
-Prélever 1 mL de lait dilué, le faire doucement couler le long de la paroi afin qu’il se dépose délicatement sur le gel.
-Ouvrir le robinet pour faire pénétrer le lait dans le haut du gel, refermer le robinet.
Elution
-Placer le tube à hémolyse n°1 en sortie de colonne.
-Prélever 1 mL d’eau distillée, faire couler doucement le long de la paroi afin qu’il se dépose délicatement sur le gel. Ouvrir le robinet pour faire pénétrer l’eau distillée dans le haut du gel, refermer le robinet.
--Introduire de l’ED sur 15 cm au-dessus du gel (verser doucement à la pipette graduée le long de la paroi).
--Ouvrir le robinet, régler le débit d’élution à 1 goutte / 7 secondes. Le débit doit rester constant : pour cela, il faut le contrôler régulièrement et il faut que la hauteur d’ED au-dessus du gel reste constante.
--Lorsque le volume d’éluat recueilli dans un tube a atteint le trait de jauge du tube, placer le tube suivant en sortie de colonne.
-Dès qu’un tube de fraction a recueilli 2 mL d’éluat, pratiquer les deux tests de révélation sur cette fraction.
Révélations des biomolecules
Matériel
- Tubes de fraction avec 2 mL d’éluat
- Tubes à essai haut numérotés de 1 à 10, carrés de papier aluminium, coton cardé
- P1000 et cônes
- Bain thermostaté à 80 °C et portoir,
- Gants anti-chaleur / pince en bois
Réactifs
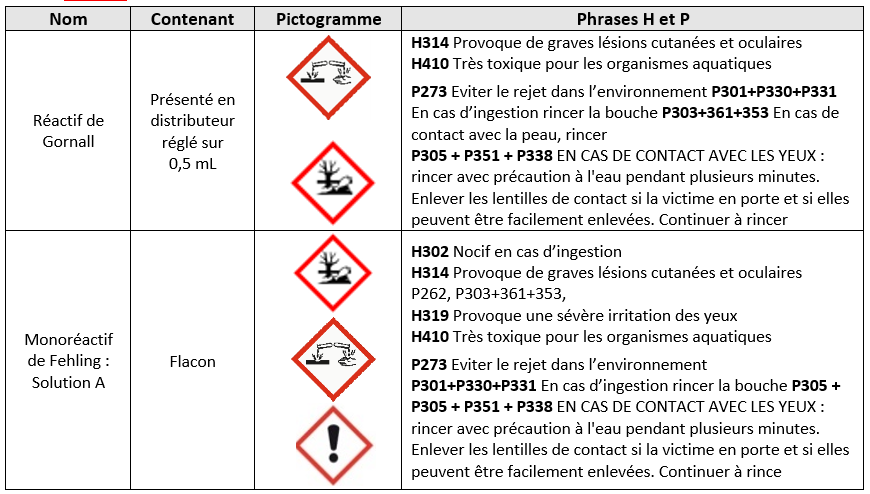
Test à la liqueur de Fehling
-Tester un volume de fraction recueillie : transférer 1 mL de la fraction d’éluat X dans un tube à essai X’.
-Introduire dans chaque tube à essais n°1 à n°10, 200 µL de solution A et 200 µL de solution B de Fehling
-Boucher le tube avec un peu de coton cardé puis un carré d’aluminium puis placer le tube au bain thermostaté à 80 °C pendant 3 minutes.
-Observer la couleur obtenue et son intensité (notée - à +++).
Test avec le réactif de Gornall :
-Dans le volume restant d’éluat du tube à hémolyse (1 mL), ajouter 1 mL de réactif de Gornall.
-Observer la couleur obtenue et son intensité notée (- à +++) après 10 minutes à l’obscurité.
Données :
|
Test à la liqueur de Fehling
|
Témoin de spécificité
|
Témoin d’efficacité
|
|
Composition : Fehling A et B + ….
|
Eau déminéralisée
|
Solution de glucide réducteur
|
|
Lecture
|
Bleu clair
|
Rouge brique
|
|
Test avec le réactif de Gornall
|
Témoin de spécificité
|
Témoin d’efficacité
|
|
Composition : Réactif de Gornall + ...
|
Eau déminéralisée
|
Solution de protéine
|
|
Lecture
|
Bleu clair
|
Violet
|
RESLTATS OBTENUS


Réaliser la démarche risque et prévention pour le test à la liqueur de Fehling et au réactif de Gornall.
Un état frais du gel Séphadex G25 hydraté a été réalisé.
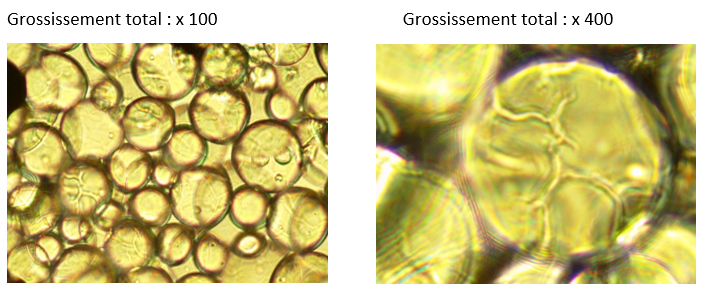
Source : livre Biotechnologie Delagrave
Schématiser un champ d’observation et décrire ce gel à partir du grossissement x400.
Identifier les composants du lait qui seront mis en évidence lors de la révélation.
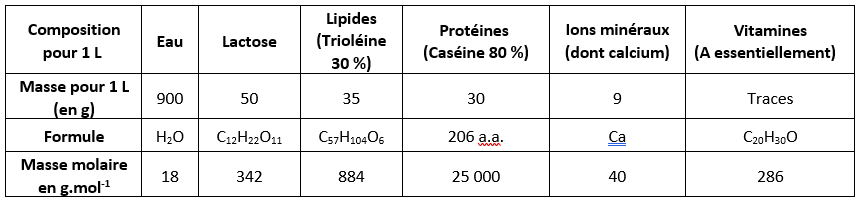
Indiquer pour chacun : une catégorie de molécule organique, un nom de molécule présente dans le lait et sa masse molaire.
Etablir un lien entre la couleur blanche et certaines molécules du lait.
A partir de la courbe d’élution, déterminer le volume correspondant à chaque pic d’élution des molécules recherchées. Comparer avec la masse molaire des molécules.
En déduire une relation entre la masse molaire d’une molécule (représentant la « taille » d’une molécule) et sa vitesse d’élution lors d’une chromatographie de gel filtration.
En s’appuyant sur la structure du gel Séphadex (voir état frais), proposer une explication à la relation proposée.
Compléter le schéma d’observation de l’état frais du gel : tracer les parcours dans le gel d’une molécule de lactose (en rouge) et d’une molécule de caséine (en vert).
Les gels sont caractérisés par leur domaine de fractionnement (masses molaires des molécules à partir desquelles le passage dans les galeries des billes est impossible). Le domaine de fractionnement du gel utilisé est de 1 000 à 5 000 g·mol-1.
Justifier l’emploi de ce gel pour séparer les protéines et le lactose du lait.
D’après les courbes d’élution, commenter l’efficacité séparative de votre chromatographie. Justifier la réponse.
Indiquer si cette méthode chromatographique à un but préparatif ou analytique. Justifier la réponse.