Préambule : les informations, valeurs, tableaux, graphes et questions présentées ci-dessous ne sont qu'une partie du sujet étudiée.
Certaines questions ne figurent pas dans le document support de l'activité mais ont été posées au cours des séances.
La levure de bière est un champignon unicellulaire microscopique appelé Saccharomyces cerevisiae (saccharo- signifie « sucre », myces « champignon » tandis que cerevisiae fait référence à « cervoise », nom donné autrefois à la bière). La véritable levure de boulangerie (attention : pas la levure chimique) appartient elle aussi à l’espèce Saccharomyces cerevisiae.
- L’objectif de la séance consistera à vérifier les conditions de croissance d’une souche de S. cerevisiae pour obtenir une production maximale de levure de bière active afin lancer une fermentation alcoolique (cf. AT précédentes).
A. Vérification des caractères morphologiques et culturaux de S. cerevisiae
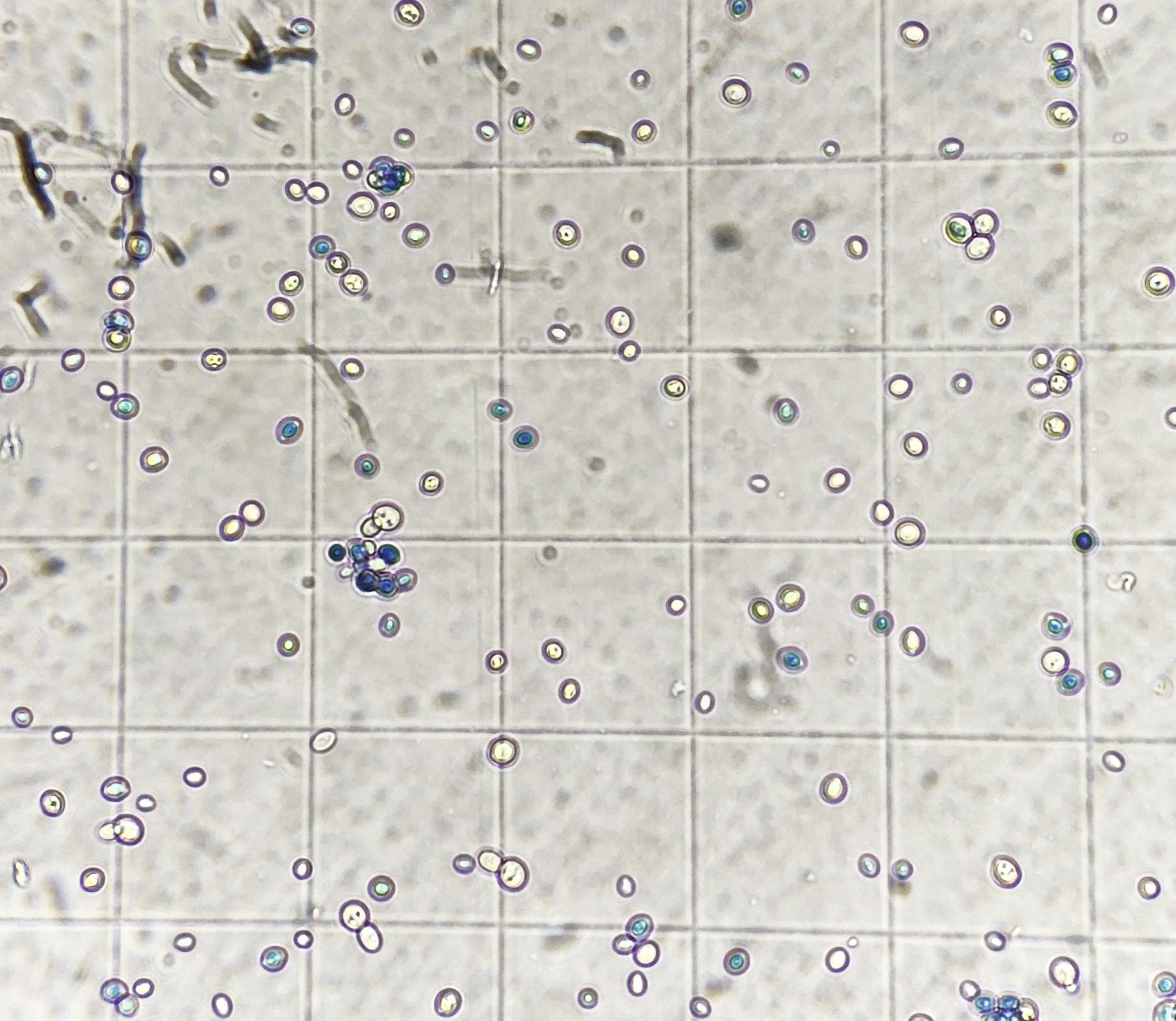
- Réaliser un dénombrement dans un rectangle de comptage de l'hématimètre de Malassez
=> estimation rapide de la concentration cellulaire (cf. AT "Cytométrie directe")
=> vérification de la morphologie des levures et de leur mode de division
Ce-dessous un rectangle de comptage (volume = 0,01 µL soit 0,00001 mL ou encore 10-5 mL) après coloration vitale au bleu de Funk
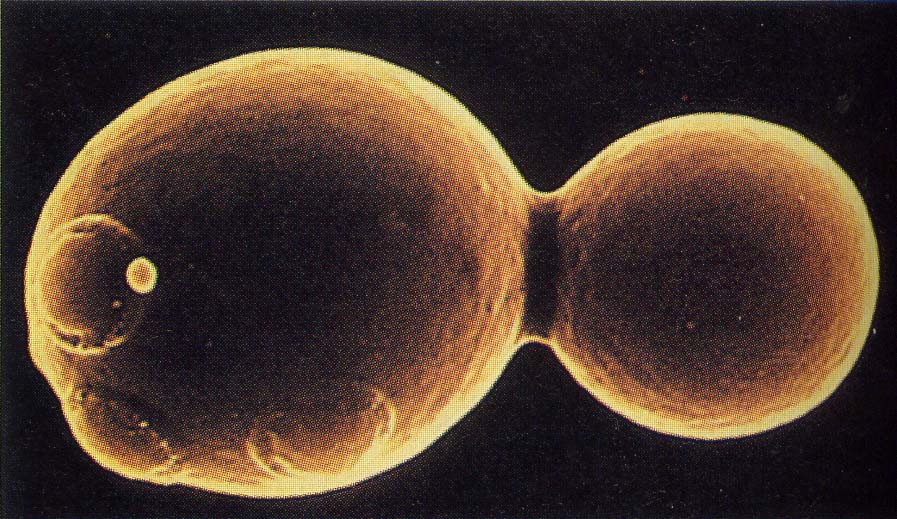
Ci-dessous une électronographie (photographie prise au microscope électronique à balayage), montrant:
- une cellule-mère,
- un bourgeon en formation (à droite),
- des cicatrices de bourgeonnment (à gauche)
- Réaliser un isolement sur gélose Sabouraud en petite boite de Pétri.
=> permet de vérifier l'aspect macroscopique des colonies (taille, contour, aspect, surface, consistance, opacité, couleur, type)
=> permet de vérifier la pureté de la suspension utilisée au cours des manipulations (attention à bien réaliser l'isolement en fin de manipulation)

B. Vérification des paramètres de culture de la souche de Saccharomyces cerevisiae (jour 1)
- Un flacon de 10 mL de bouillon Sabouraud stérile, pH 6, est fourni.
- Réaliser les ensemencements suivants en tubes à hémolyse, avec 10 µL de bouillon de levure fourni (culture de 18 h en milieu Sabouraud), en condition aseptique :
|
Ensemencer (10 µL) trois bouillons Sabouraud (1 mL par tube) puis les placer respectivement
|
|
Bouillons
|
B1
|
B2
|
B3
|
|
Lieu & température d’incubation
|
4 °C, 24 h
Au réfrigérateur
|
20 °C, 24 h
Température ambiante
|
37 °C, 24 h
étuve
|
|
Ajuster le pH de trois bouillons Sabouraud (1 mL par tube)
|
|
Bouillons
|
B4
|
B5
|
B6
|
|
pH
(à vérifier avec le papier pH)
|
< pH 4
acidifier avec 4gouttes de HCL 1 mol.L-1
Estimer le pH au papier pH
|
pH 6
|
pH 8
alcaliniser avec 4gouttes de NaOH 1 mol.L-1
Estimer le pH au papier pH
|
|
Inoculer chaque bouillo avec 10 µL de bouillon de levure puis étuver à 30 °C pendant 24 h
|
|
Régénérer 2 bouillons en les plaçant 30 minutes dans un bain d’eau thermostaté à 100 °C, les laisser refroidir puis ensemencer avec 10 µL de bouillon de levure
|
|
Bouillons
|
B7
|
B8
|
|
Mise en présence de 02 atmosphérique
|
Non
milieu …………………
Recouvrir le bouillon ensemencé d’une couche de vaseline stérile
|
Oui
milieu ………………
Ne pas recouvrir de vaseline stérile
|
|
Étuver à 37 °C pendant 24 h
|
- Proposer un témoin positif et un témoin négatif pour chaque série d’expérience.
C. Dénombrement cellulaire par turbidimétrie (jour 2)
- Transférer le contenu de chaque tube dans une semimicro-cuve pour spectrophotomètre de 1 mL. Parafilmer.
Mesurer l’atténuance (cf. page 4) à la longueur d'onde choisie contre un blanc réactif adapté.
=> Cette technique permet une mesure extrêmement rapide de la concentration cellulaire, mais présente un inconvénient. Lequel ?
- Dans chaque cuve de mesure, ajouter 5 gouttes de bleu de bromothymol. Faire de même sur un bouillon non ensemencé. Relever les couleurs obtenues.
=> Ceci permet de comparer la variation de pH au cours de la croissance de le levure, de façon subjective.
Indicateur : bleu de bromothymol, jaune pour pH < 6 et bleu pour pH > 7,6)
|
Bouillon
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
Conditions
Opératoires
|
|
|
|
|
|
|
|
|
|
Appréciation visuelle du trouble (critère subjectif)
|
|
|
|
|
|
|
|
|
|
Couleur de l'indicateur coloré de pH
|
|
|
|
|
|
|
|
|
|
pH du milieu
(acide, basique, neutre)
|
|
|
|
|
|
|
|
|
|
Dà 650 nm
(critère objectif)
|
|
|
|
|
|
|
|
|
|
CN (levures ; bouillon)
|
|
|
|
|
|
|
|
|
Pour estimer la concentration en levures, on considèrera qu’une atténuance de 1 correspond à environ 1,7?x107 levures.mL-1.