Objectif : vérifier la concentration en levures d'une préculture (cellules fraichement isolées ou diluées de façon à être rapidement en phase de croissance lors d’une utilisation ultérieure : pour ensemencer un moût, amorcer ou activer efficacement une fermentation …) destinée à la réalisation d'une bière, en utilisant une méthode alternative à la cytométrie directe en hématimètre de Malassez le dénombrement sur milieu solide (choisi en fonction des micro-organismes à dénombrer) existe sous deux variantes, celle mise en oeuvre ette semaine consiste à introduire dans la masse d'un milieu gélosé, préalablement maintenu en surfusion, un inoculum connu de dilutions croissantes du produit à étudier. cette méthode va permettre de déterminer la concentration des levures viables de l’échantillon analysé en UFC · mL-1.
Dénombrement des levures vivantes par cytométrie directe
Un dénombrement en hématimètre de Malassez est réalisé dans les plus brefs délais pour déterminer la concentration en nombre de levures dans la suspension.
Ce calcul va permettre de savoir quelles dilutions réaliser pour réaliser un dénombrement par ensemencement dans la masse (ou en surface, au choix) sur un nombre limité de géloses (3 en tout)
Choix du milieu de culture à utiliser et préparation
Le choix du milieu à utiliser dépend des micro-organismes à dénombrer; Il convient donc de connaître au préalable un certain nombre de milieu et leurs propriétés ou de savoir déterminer les propriétés d'un milieu à l'aide de sa composition.
Ex. 1 : le milieu PCA (Plate Count Agar) : utilisé en bactériologie alimentaire pour le dénombrement des bactéries aérobies dans le lait, les viandes, les produits à base de viande, les autres produits alimentaires, ainsi que pour l’analyse des produits pharmaceutiques, des produits cosmétiques et de leurs matières premières.
Composition en g · L-1 de milieu :
Tryptone : 5,0 g · L-1
Extrait autolytique de levure : 2,5 g · L-1
Glucose : 1,0 g · L-1
Agar agar : 15,0 g · L-1
pH du milieu prêt à l'emploi à 25 °C : 7,0 ± 0,2.
Ex. 2 : le milieu Sabouraud + chloramphénicol : la gélose de Sabouraud au chloramphénicol est recommandée pour l’isolement des levures et des moisissures, surtout lorsque les prélèvements sont fortement contaminés par des bactéries.
Peptone 10 g · L-1
Glucose 20 g · L-1
Agar 15 g · L-1
Chloramphénicol : 0,5 g · L-1
pH du milieu prêt à l'emploi : 5,7 ± 0,2
D'après le dénombrement envisagé, indiquer lequel de ces deux milieux est le plus adapté.
Choix des dilutions à effectuer
Connaissant déjà la concentration en nombre de cellules viables dans le produit étudié (cf. partie 1), il faut savoir quelle(s) dilution(s) réaliser pour répondre aux conditions suivantes :
- le nombre maximal de colonies par boite est de 150 pour les levures (300 pour ds bactéries sur un milieu ne permettant pas de lire de caractèresd biochimiques)
- la concentration mesurée en levures vivantes CN (levures vivantes ; préculture) dans la préculture est 8,0·106 cellules · mL-1
- la préculture doit être diluée successivement en série (en cascade) de raison géométrique 1/10 dans des tubes de 9 mL de diluant (eau physiologique) ;
- l’inoculum à ensemencer dans la masse du milieu gélosé est de 1 mL.
Pour calculer la dilution a effectuer ;
- il suffit de partir de l'équation aux grandeurs permettant de calculer la CN (levures vivantes ; préculture)

- d'isoler "d", la dilution voulue
- de choisir un nombre de colonies (correspondant au nombre de levure N) inférieur à 150 (consigne précédente) et permettant une simplification avec CN
D'après les indications précédentes, montrer que la dilution à réaliser est 10-5.
Toutefois, étant donné l'incertitude, trois dilutions successives doivent être testées, afin d’encadrer la dilution précédemment choisie.
Réalisation des dilutions et ensemencement
Etapes d'un pipetage en microbiologie :
Photo 1) pointe de la pipette immergée dans la suspension préalablement homogénéisée, prélever, en zone stérile, pipette droite, la suspension en dépassant le volume désiré.

Photos 2) pointe de la pipette appuyée contre la paroi du tube mais plus immergée dans la suspension, rejeter doucement l'excédent de volume ; la suspension n'étant pas colorée, le bas du ménisque doit affleurer avec la graduation correspondant au volume voulu.

Photo 3) pour éviter toute perte de suspension (sur la paillasse, le portoir, les doigts...), pipette toujours en dehors de la suspension, aspirer un petit volume d'air ; l'ajustage ayant été préalablement réalisé, le volume désiré (ici 1,0 mL) peut être manipulé sans risque de pertes.

Photo 4) répartition de l'inoculum en petites gouttes déposées dans le fond de la boite de Pétri stérile.

Rédaction du plan d'étude la manipulation :

Erratum : milieu "Sabouraud' et non pas "Sanouraud" !!
les points critiques sont nombreux sur cette technique :
- mauvaise utilisation de la pipette graduée stérile de 1 mL entraînant des dilutions erronées
- mauvaise homogénéisation (ou absence d'homogénéisation) de la suspension initiale et lors de la réalisation de chaque dilution
- utilisation d'une seule pipette pour réaliser l'ensemble des dilutions (changer de pipette après chaque dilution réalisée)
- intervalle de temps trop long entre le dépôt de l'inoculum dans chaque boite (sous forme d'une quinzaine de gouttes) et le dépôt de la gélose en surfusion (les micro-organismes auront le temps d'adhérer au support, et même une homogénéisation correcte ne permettra pas de les "décrocher")
- gélose coulée trop chaude sur les micro-organismes, les tuant partiellement voire totalement (penser à homogénéiser le flacon de gélose en surfusion après sa sortie du bain thermostaté ; la gélose peut être coulée quand on peut tenir sans difficulté le flacon en main, notion toutefois très subjective !)
- gélose qui a trop refroidi et commence à prendre en masse dans le flacon avant de verser dans les boites
En parallèle, réalisation d'un dénombrement des levures vivantes d'une bière sur lie :
Bière sur lie : une description :
"Les bières sur lie demeurent mystérieuses pour plusieurs amateurs. La lie est en fait cet amalgame de levures qui sédimentent à l’issue de la fermentation. Chez les bières non filtrées ou refermentées en bouteille comme on en rencontre beaucoup en Belgique, la lie sera visible, ce qui fait que si on verse une bière dans deux verres, le premier pourrait bien être limpide alors que le deuxième sera trouble du fait que la lie se trouvera en suspension. La texture de la deuxième risque alors d’être plus crémeuse et les arômes pourraient aussi différer. Les deux verres sont tout aussi bons pour la santé et permettent d’apprécier deux bières légèrement différentes en une."
A consommer avec modération après sa majorité uniquement !

Analyse des résultats de croissance et calculs de dénombrement
Voici trois exemples de dénombrement, réalisés à partir de la même préculture par trois élèves (Manipulateurs) différents ; tous les autres paramètres sont identiques : mêmes Méthode, Milieu, Moyens, Matière.

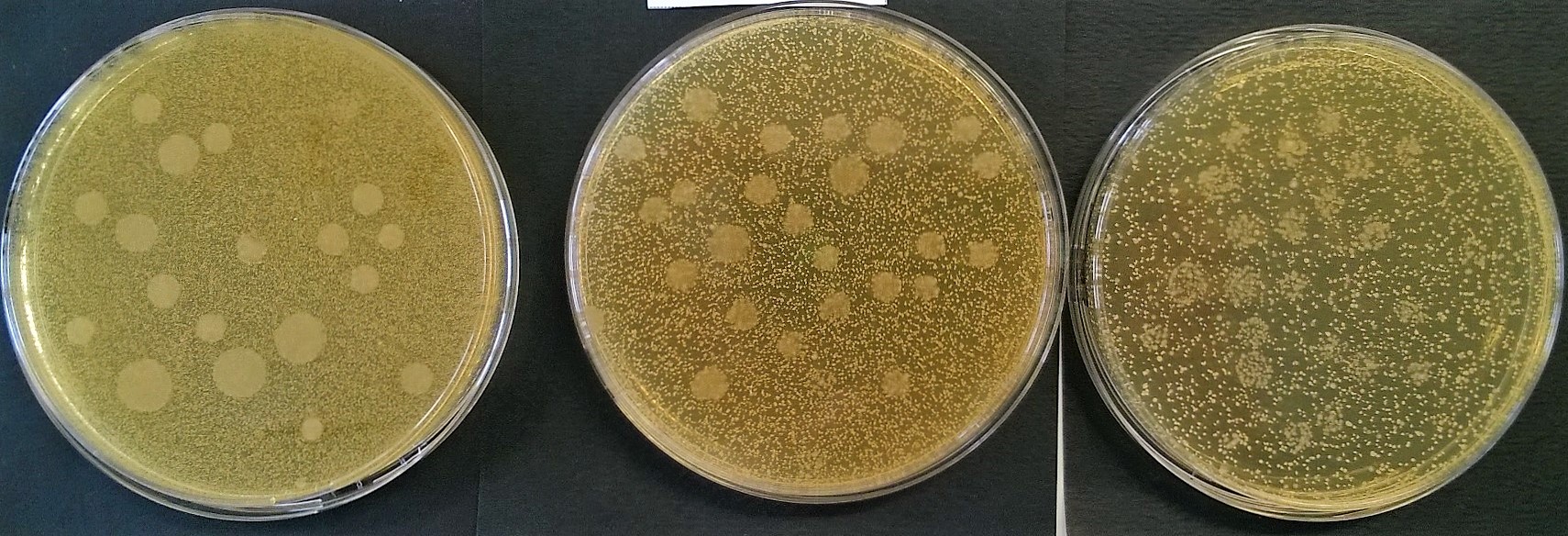
Commenter la qualité de la réalisation de chacun de ces isolements. Indiquer quelles erreurs ont pu être commises (voir ci-dessus 3ème partie : "points critiques").
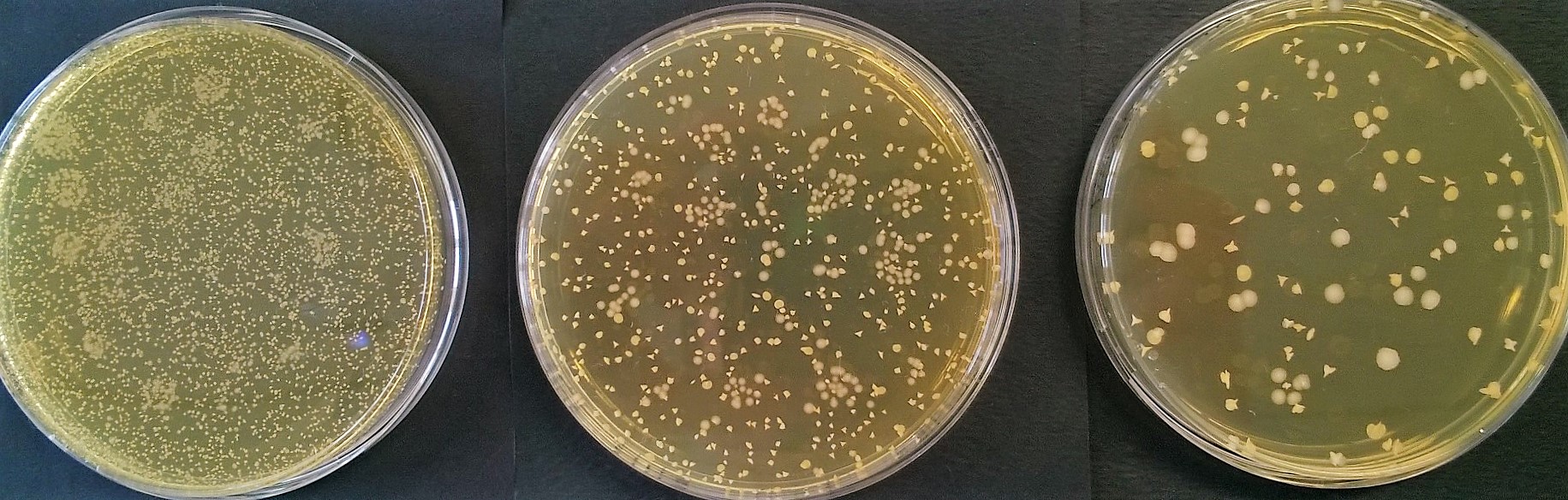
Voici une autre série de résultats, obtenus sur des dilutions plus importantes :

Effectuer le comptage des colonies.
Analyser la cohérence interdilution dans chacun des deux cas (on considèrera que la cohérence entre deux dilutions successives est satisfaisantes si le rapport du nombre de colonies est compris entre 8 et 12)
Indiquer si la norme IS07218 officialisant l'utilisation d'une seule boite par dilution peut être appliquée (voir Fiche Technique expliquant la norme)
S'agissant de levures, et toujours d'après cette norme, indiquer quelle(s) boite(s) pourraient être retenues pour les calculs.
Deux aspects de colonies de levures (sur les trois observables) après culture (technique d'incorporation dans la masse d'un milieu gélosé) :
Photo 1) colonie circulaire et très aplatie (par la masse de gélose) s'étant développée sur le fond de la boite

Photo 2) un petit carré de gélose a été découpé pour mettre en évidence le développement de la colonie en partie dans la masse de la gélose et en partie en surface

Colonie de levure obsservée à la loupe binoculaire Gt x 20 et x40


Exemple d'analyse en temps réel, au laboratoire avec les élèves, du résultat du dénombrement

