Préambule : les informations, valeurs, tableaux, graphes et questions présentées ci-dessous ne sont qu'une partie du sujet étudiée.
Certaines questions ne figurent pas dans le document support de l'activité mais ont été posées au cours des séances.
Certaines personnes présentent un mal au ventre, des diarrhées, des ballonnements et éventuellement des vomissements dans les 30 minutes à 2h après chaque ingestion de produits laitiers. La cause de ces symptômes est une intolérance au lactose, c'est-à-dire l’incapacité à digérer le lactose (principal glucide du lait) à cause de l’absence ou de la quantité insuffisante d’une enzyme digestive, la lactase, qui dissocie le lactose en galactose et en glucose :
lactase
enzyme de classe hydrolase
lactose + H20 ======================> galactose + glucose
substrat produits
Après le sevrage des nourrissons, l’intolérance au lactose est le fonctionnement originel de tous les mammifères (humain compris) ; c'est un caractère ancestral qui s’acquiert très tôt dans l’enfance. Cependant des mutations génétiques ont eu lieu il y a à peu près 10 000 ans et se sont propagées favorablement dans certaines régions où la consommation de lait s'est répandue (le Caucase et une région d'Afrique).
À titre d'illustration, 75 % des adultes dans le monde présentent une baisse de l'activité lactasique mais 90 % des Européens du nord possèdent aujourd'hui la mutation génétique qui les rend tolérants au lactose.
Afin de comprendre quel lait est le plus adapté aux personnes présentant cette intolérance, on se propose d’effectuer un dosage biochimique du lactose contenu dans différents laits.
Ce dosage colorimétrique est basé sur la propriété des glucides réducteurs (comportant une fonction aldéhyde libre) de réagir, grâce à la fonction aldéhyde libre, en milieu alcalin et à chaud, avec l'acide 3-5 dinitrosalicylique (3,5-DNS).
On opère par référence à une gamme d'étalonnage (qui ne passe pas par zéro).
Le 3,5-DNS jaune est réduit en acide 3-amino-5-nitrosalicylique orangé-rouge.
1ère partie : réalisation simultanée de la gamme d'étalonnage et des essais
|
tube
|
0
|
1
|
2
|
3
|
4
|
5
|
E1
|
E2
|
|
ρ (SE lactose ;tube) en g.L-1
|
0
|
|
|
|
|
0,6
|
?
|
?
|
|
V SE lactose en µL
|
0
|
|
|
|
|
180
|
/
|
/
|
|
V lait à tester en µL
|
/
|
/
|
/
|
/
|
/
|
/
|
300
|
300
|
|
qsp H20 en µL
|
300
|
|
|
|
|
|
0
|
0
|
|
DNS en µL
|
200
|
200
|
200
|
200
|
200
|
200
|
200
|
200
|
|
Boucher les tubes au coton cardé et papier aluminium
Placer au Bain Marie à 100°C pendant 5 minutes exactement
|
|
Arrêter la réaction en plaçant les tubes 2 minutes dans un bain d’eau glacée
|
|
Ajouter 1,5 mL d’eau distillée
Attendre 15 minutes avant de transférer dans les cuves de lecture
|
|
Aà 530 nm
|
|
|
|
|
|
|
|
|
|
mlactose en mg
|
0
|
0,036
|
0,072
|
0,108
|
0,144
|
0,180
|
?
|
?
|
|
Référence spectrophotomètre :
|
1) Quelle est la raison de la progression géométrique de la gamme d'étalonnage, qui comprend 6 tubes allant de 0 à 0,6 g.L-1 de lactose. La raison doit être prouvée par la calcul.
2) La solution étalon de lactose à une concentration ρ (lactose ; sol. étalon) = 0,6 g.L-1. En utilisant la loi de conservation de la masse, calculer, pour chaque tube, V SE lactose à introduire, en µL.
3) le tube 0 est qualifié de blanc réactif et sert à ajuster à zéro le spectrophotomètre afin de réaliser les mesurages d'absorbance à la longueur d'onde de travail. Commenter la composition de ce tube et expliquer pourquoi il va permettre de mesurer la coloration développée dans les tubes suivants après la réaction entre le lactose et le DNS
4) Pour effectuer le mesurage de l'absorbance, il faut toutefois, avant d'ajuster à zéro, régler la longeur d'onde sur le spectrophotomètre. Le graphe suivant permet de choisir la longueur d'onde de travail:
- Expliquer comment est réalisé un spectre d'absorption ;
- Indiquer quelle longueur d'onde choisir pour ce dosage, et justifier la réponse.

Remarque : au cours de ce dosage, les élèves ont été confronté au problème suivant :
1) le contenu de chaque tube est devenu particulièrement foncé (le spectrophotomètre saturait à 3,000)
2) le contenu de chaque tube avait coagulé !
Une très bonne occasion de mettre en oeuvre le diagramme d'Ishikawa (appelé aussi cause-effet ou en arête de poisson) pour trouver la ou les sources d'erreurs :

Nous avons donc focalisé notre attention sur la matière (solution étalon de lactose) :
1) la couleur très foncée indique que la concentration en lactose est très importante ; la soltion étalon n'était donc pas à la concentration initialement prévue.
2) la coagulation a été expliquée par les élèves comment étant due à la présence de protéines dans la solution étalon ! mais comment des protéines ont-elles pu se retrouver dans une solution ne contenant normalement que de l'eau distillée dans laquelle a été dissout du lactose en poudre ?
a) des protéines résiduelles le long de la paroi de la fiole jaugée ayant reçu la solution étalon ? Il y en aurait seulement eu des traces, incompatibles avec un tel phénomène de coagulation
b) un problème avec le diluant ? Un regard sur la matière d'oeuvre donnée à la technicienne a permis de voir que la solution a été préparée non pas dans de l'eau distillée mais dans du lait "délactosé" commercial (un copier/coller malencontreux...) ; or, non seulement le lait est évidemment très riche en protéines, expliquant la coagulation observee, mais le lait "délactosé" contient environ 0,5 % (m/V) de lactose résiduel, soit 5 g.L-1 ! or la solution étalon devait être à 0,6 g.L-1...
Un échec de manipulation mais un excellente illustration d'une analyse a posteriori selon une méthode incontournable pour mettre en évidence ce qui fut à l'origine de cet échec.
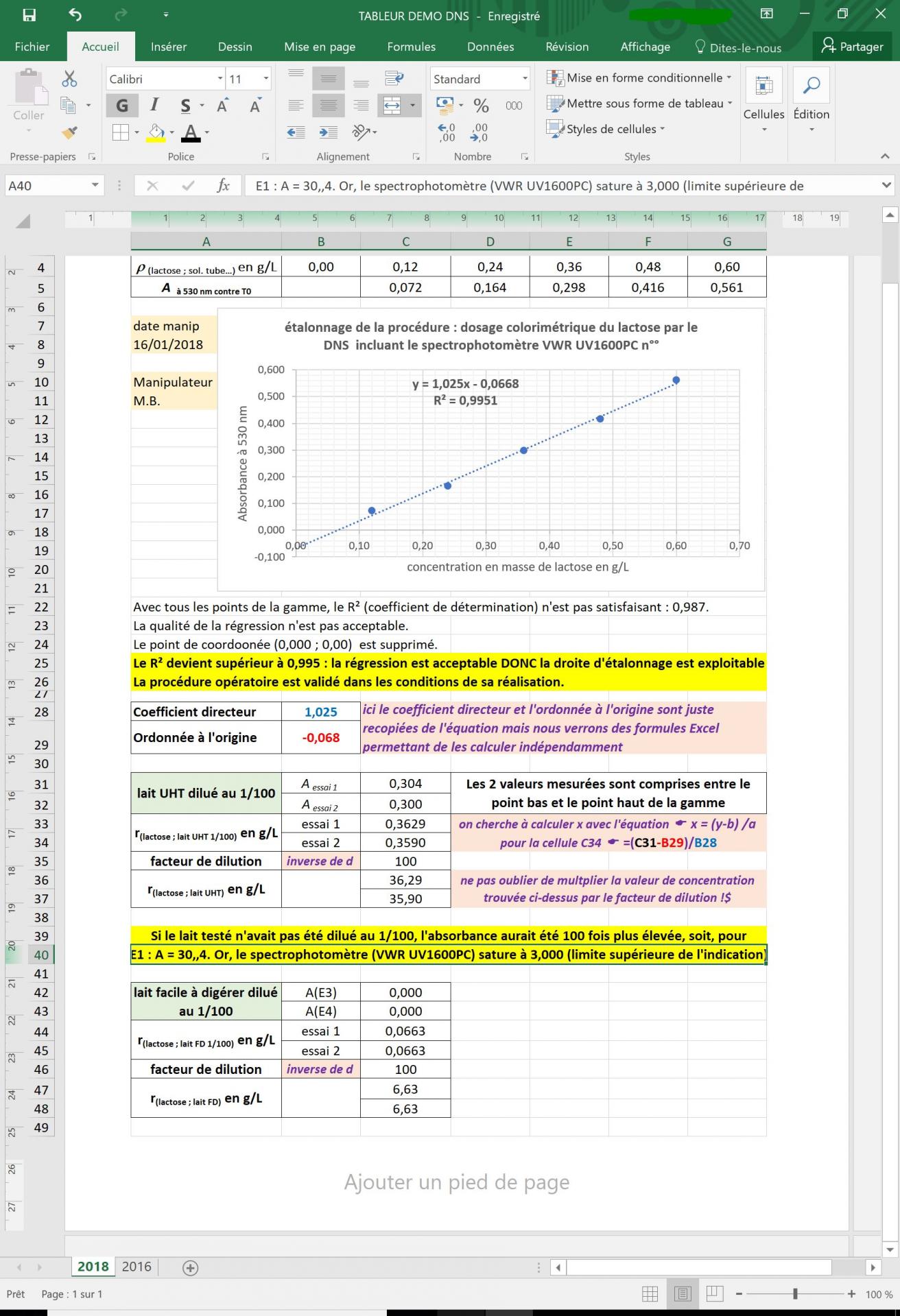
L'exemple ci-dessous montre l'exploitation de valeurs mesurées dans le cas d'un dosage correctement réalisé, à l'aide d'un tableur-grapheur
(ici Calc de la suite bureautique gratuite Libreoffice).
Cette exploitation permet d'acquérir ou de consolider les compétences suivantes :
- Saisir de données (valeurs, texte) avec une mise en forme répondant aux normes d'écriture des grandeurs (incides, exposants...
- Tracé d'une droite d'étalonnage (nuage de points sous Excel ou XY (dispersion) sous Calc)
- Affichage de l'équation de la droite (de type y = ax + b) et du coefficient de détermination R² (indicateur de la qualité de la régression linéaire, autrement dit de la qualité de l'alignement des points)
- Supression éventuelle de valeurs erronées permettant d'améliorer la qualité de la régressionµ
- Validation (ou non) de la gamme d'étalonnage et de la procédure
- Détermination par le calcul, en utilisant les paramètres de la droite (pente et ordonnée à l'origine), des concentrations en lactose dans chacun des deux essais (lait dilué au 1/100) puis du lait non diluée
- Vérification de la compatibilité métrologique des deux valeurs mesurées à l'aide de l'écart-type de répétabilité (non montré ici)
 Bonjour , cmt calculer le facteur de dilition pour évaluer la valeur réel d'un échantillon dont à mesurer l'absorbance
Bonjour , cmt calculer le facteur de dilition pour évaluer la valeur réel d'un échantillon dont à mesurer l'absorbance

