Avant de réaliser un suivi de croissance d'un micro-organisme, il est nécessaire, pour chaque micro-organisme étudié, d'établir un étalonnage entre l'atténuance d'une suspension microbienne et la concentration en nombre de ce micro-organisme dans la suspension.
Le principe mis en oeuvre est celui de la turbidimétrie, c.à.d. du trouble d'un milieu ; si l'appareil mis en oeuvre est un spectrophotomètre, le phénomène mis en jeu est différent ; il ne s'agit pas d'une absorption du faisceau lumineux incident mais d'une diffraction des rayons lumineux incidents par les cellules en suspension.
C'est pour cette raison qu'on utilise le terme d'atténuance (symbole D) et non d'absorbance.
Cette relation est effectuée en deux temps, sur trois micro-organismes différents :
- Escherichia coli, bacille à Gram négatif, généralement isolé
- Staphylococcus epidermis, coque à Gram positif, généralement en amas
- Saccharomyces cerevisiae, champignon unicellulaire de type levure
Vérification de la proprotionalité entre l'atténuance et la concentration bactérienne
Pour chaque micro-organisme testé, on réalise les étapes suivantes :
Cultures par binôme
la procédure sera effectuée à partir d’un tube de préculture en bouillon DM (10 mL) après 18 heures à 37 °C d’une souche d’Escherichia coli (classe 1).
Milieux par binôme
10 mL de bouillon DM stérile dans un tube à vis.
Matériel par binôme
Parafilm® prédécoupé en boite de Pétri ;
8 micro-cuves de mesure avec portoir ;
1 seule pipette graduée stérile de 1 mL + dispositif d’aspiration
Préparation des dilutions de suspension microbienne
- Dilutions de raison connue d’une culture microbienne
- Mesure de l’atténuance à une longueur d’onde adaptée (600 ou 650 nm)
À partir de la culture de 18 heures, réaliser la gamme de dilution suivante dans 8 semi-microcuves et en milieu DM stérile :
|
Cuve n°
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
|
Milieu DM (mL)
|
1,0
|
0,95
|
0,9
|
0,8
|
0,6
|
0,4
|
0,2
|
0,0
|
|
Culture (mL)
|
0,0
|
0,05
|
0,1
|
0,2
|
0,4
|
0,6
|
0,8
|
1,0
|
|
Dilution (d) effectuée
(sous forme de rapport)
|
|
|
|
|
|
|
|
|
|
Dilution (d)
(sous forme décimale)
|
|
|
|
|
|
|
|
|
|
Atténuance mesurée (Dmesurée)
à …… nm
|
|
|
|
|
|
|
|
|
|
Atténuance corrigée (Dcorrigée) à …… nm
|
|
|
|
|
|
|
|
|
Photo : réalisation des dilutions du bouillon de 18 h directement en semi-microcuves de 1 mL

Tracer le nuage de points : D à 650 nm = f (dilutions réalisées)
Atténuance d’une souche bactérienne d'E. coli en concentration croissante par turbidimétrie

Atténuance d’une souche bactérienne de Staphylococcus epidermidis en concentration croissante par turbidimétrie
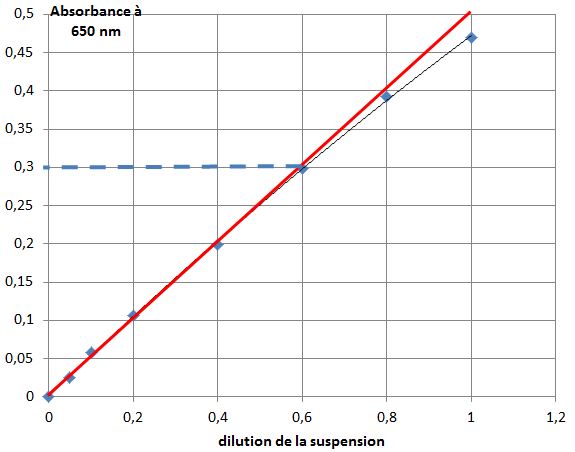
Atténuance d’une souche de levure Saccharomyces cerevisiae en concentration croissante par turbidimétrie

L'atténuance est-elle toujours proportionnelle à la concentration microbienne (inverse de la dilution réalisée) ?
A partir de quelle valeur d'absorbance la relation de proportionnalité n'est-elle plus valable ?
Une loi mise en oeuvre en spectrophotométrie serait-elle applicable ici ?
Dans quelle "dilution" (cuve) mesure-t-on l'atténuance d'une suspension pure (non diluée) ?
Que faut-il faire si l'atténuance mesurée d'une suspension microbienne est supérieure à l'atténuance limite précédemment déterminée ?
Etalonnage de la procédure : établir une correspondance entre l’atténuance et la concentration en nombre de micro-organismes
Pour chaque micro-organisme testé, on réalise les étapes suivantes :
- Dilutions de raison connue d’une culture microbienne
- Dénombrement de trois dilutions successives par méthode ensemencement en surface d'un volume connu et étalement en surface par billes de verre stériles
Cultures (par binôme)
-Un tube de préculture en bouillon DM (10 mL) après 18 heures à 37 °C d’Escherichia coli.
Milieux (par élève)
-3 géloses PCA (Plate Count Agar), milieu couramment utilisé pour le dénombrement
Matériel (par élève)
-Tubes d’eau physiologique de 9 mL exactement ? nombre à déterminer
-Pipettes graduées stériles de 1 mL ? nombre à déterminer
-Billes de verre stériles (1 tube contenant environ 30 billes) ou étaleur stérile + pot d’eau de Javel
Préparation des dilutions de suspension microbienne (fiche à télécharger)
Déterminer jusqu'à quelle dilution décimale procéder, à partir de la préculture fournie et avec les données suivantes
Données :
- Une culture de 18 h d'Escherichia coli contient environ 4⋅108 bactéries·mL-1 (parfois jusqu'à 2⋅109), de Staphylococcus epidermidis contient environ 4⋅108 bactéries.mL-1, de Saccharomyces cerevisiae contient environ 1 à 5⋅107 levures.mL-1
- Le volume d'inoculum est de 0,1 mL ;
- On peut dénombrer entre 10 et 300 colonies par gélose (sur un milieu ne comportant pas d'agent de différenciation)
- La dilution retenue sera encadrée par une dilution plus élevée et une dilution plus faible.
- Les dilutions successives seront étalées sur gélose puis dénombrées après culture.
Exemple de calcul : voir en fin de page (faire glisser la barre vertical pour découvrir les réponses)
Réalisation
-Étiqueter correctement chaque boite (poste / date / dilution)
-Déposer 0,1 mL de trois dilutions choisies à la surface de géloses PCA (un essai par dilution).
-Étaler le volume déposé en veillant à ce qu’il ne reste aucune goutte de suspension en surface de la gélose.
-Laisser sécher.
-Incuber à 37 °C durant 24 h.
Photo : réalisation de dilutions en série

Dénombrement de la dernière dilution retenue par ensemencement d'un Petrifilm™ 3M™
Source : http://multimedia.3m.com/mws/media/637943O/brochure-3m-petrifilm.pdf?fn=3M%20Petrifilm.pdf

Deux exemples de résultats obtenus avec les Petrifilm "flore totale"

Exemple de dénombrement obtenu (photo en couleurs inversées pour faire ressortir les colonies)

Exemple de dénombrement avec un Pétrifilm "Entérobactéries"

Procéder au dénombrement des colonies obtenues sur les milieux ensemencées à partir des dilutions en eau physiologique. Réaliser un tableau de résultats.
Calculer la concentration bactérienne de la culture selon la norme AFNOR 7218 (ci-dessous)
Établir la correspondance entre absorbance et concentration bactérienne.
Établir l’équation reliant l’absorbance et la concentration bactérienne (le terme "formule littérale" est désuet depuis des années mais se retrouve encore parfois dans certains documents)
