Préambule : les informations, valeurs, tableaux, graphes et questions présentées ci-dessous ne sont qu'une partie du sujet étudié. Certaines questions ne figurent pas dans le document support de l'activité mais ont été posées au cours des séances.
En médecine, les enzymes sont employées essentiellement :
- comme indicateurs de la concentration (ou activité) d’enzymes dans les fluides biologique (sérum, urine, liquide céphalorachidien…) pour déceler une pathologie ;
- comme réactifs pour l’analyse de composés non enzymatiques (dosage de substrat, molécule biologique, médicament…) ou d’enzymes ;
-comme agents thérapeutiques.
Pour rechercher une pathologie, des tests enzymatiques sont fréquemment pratiqués dans les laboratoires d’analyses médicales. La plupart de ces tests sont réalisés sur des prélèvements sanguins. On peut alors doser soit un substrat, soit une activité enzymatique.
En effet, lors d’une souffrance cellulaire, des enzymes habituellement intracellulaires peuvent se retrouver libres dans le plasma à de fortes concentrations. L’aide au diagnostic est donc souvent facilitée par la connaissance de la provenance de l’enzyme retrouvée en quantité anormale. Le tableau suivant en fournit quelques exemples :
|
Enzyme
|
Source
|
|
Alanine aminotransférase (ALAT)
|
Foie
|
|
Amylase
|
Glandes salivaires, pancréas
|
|
Aspartate aminotransférase (ASAT)
|
Cœur, muscle squelettique
|
|
Créatine kinase (CK)
|
Muscle, cœur, cerveau
|
|
Phosphatase acide (PAC)
|
Prostate
|
|
Phosphatase alcaline (PAL)
|
Muqueuse intestinale, rein, os
|
Tableau 1 : provenance de quelques enzymes utiles au diagnostic médical
[D’après l’ouvrage : Enzymologie et applications de Jean-Pierre SINE (édition ellipses 2010)]
Caractérisation par bio-informatique de phosphatase alcalines
A venir
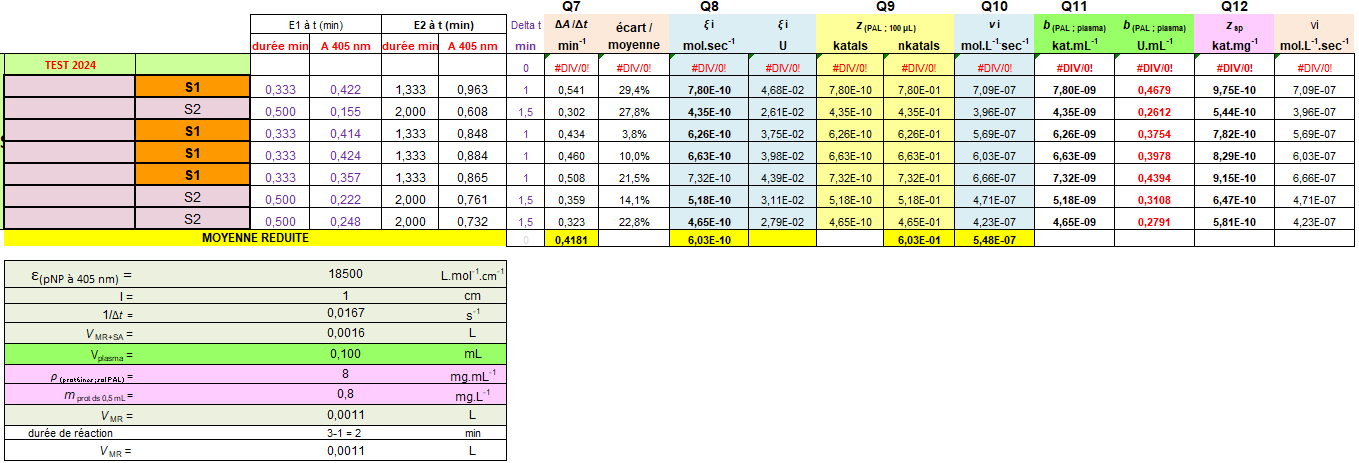
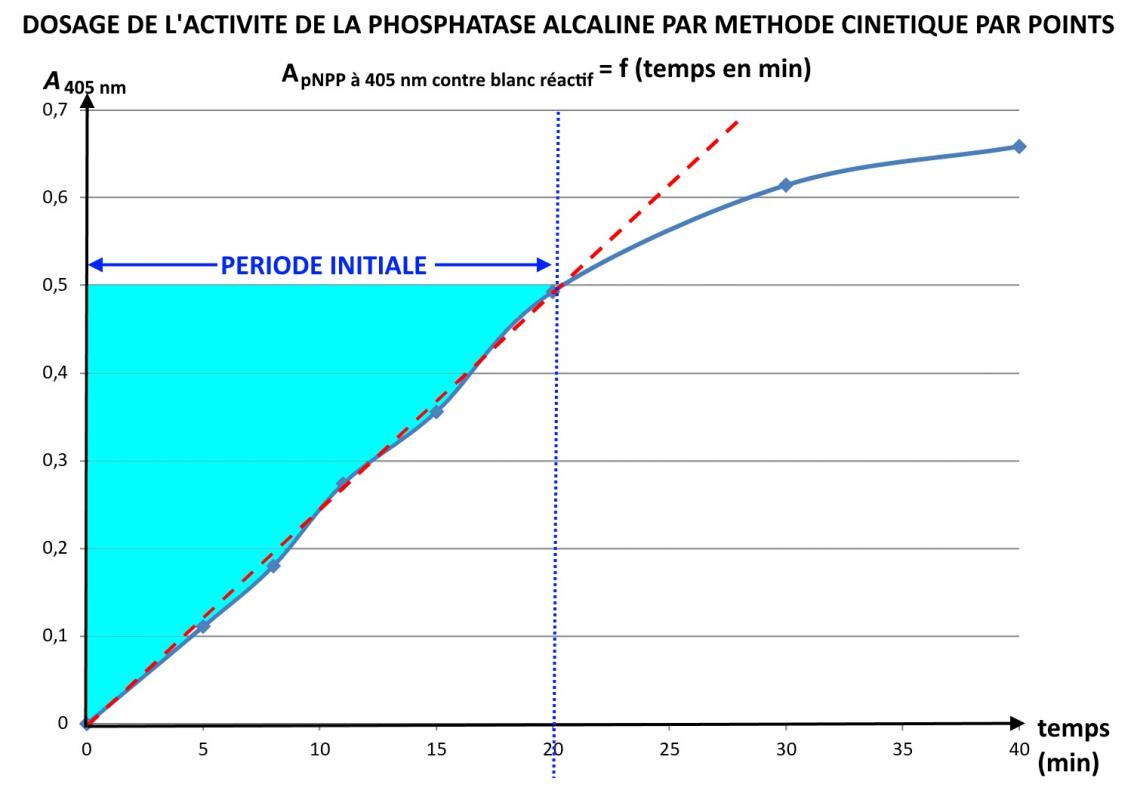
Détermination des vitesses de transformation, d'activité enzymatique et de concentration d'activité catalytique (méthode cinétique continue et 2 points)
PRINCIPE
La phosphatase alcaline PAL catalyse des réactions d’hydrolyse du groupement phosphate.
Son activité est étudiée en utilisant un chromogène (substrat incolore, en général le paranitrophénol-phosphate) qui donne un chromophore (produit coloré) après hydrolyse de son groupement phosphate.
Le pH alcalin permet de révéler la coloration du pNP et de créer un milieu favorable à l’activité de la PAL.
La réaction peut être arrêtée par une addition importante de NaOH entraînant une dénaturation irréversible de l’enzyme (ou par Na2HPO4, inhibiteur).
MOYENS
- Pipette à piston P1000 + cônes adaptés
- Semi-microcuves spectrophotométriques de 1 mL
- Spectrophotomètres réglés sur 405 nm.
- Petit matériel : poubelles, parafilm, papier filtre …
REACTIFS
- Tampon hydrogénocarbonate pH 9,8
- Solution de substrat pNPP (M = 371 g.mol-1) à 20 mmol.L-1 en tampon hydrogénocarbonate pH 9,8
- Plasma de la patiente contenant la PAL dont il faut doser l’activité à conserver dans la glace
- Solution de NaOH (à 2 mol.L-1) = solution d’arrêt.
A-Méthode cinétique continue
Préparation du poste de travail devant le spectrophotomètre
- Régler la longueur d’onde du spectrophotomètre à 405 nm.
- Préparer deux papiers Parafilm®, un chronographe, une pipette à piston de 10 µL + cônes, une pipette à piston de 1000 µL + cônes
Préparation du blanc réactif :
- Introduire dans une cuve de mesure :
- 0,5 mL de solution de substrat pNPP
- 0,5 mL de tampon hydrogénocarbonate
- Ajuster le spectrophotomètre à zéro sur cette solution.
Déclenchement de la réaction
- Une fois le spectrophotomètre ajusté à zéro, réaliser le plus rapidement possible les gestes suivants :
- Ajouter 100 µL du plasma contenant l’enzyme dont il faut doser l’activité.
- Parafilmer et homogénéiser immédiatement par retournement avec le Parafilm®.
- Placer la cuve dans le porte-cuve et immédiatement déclencher le chronographe
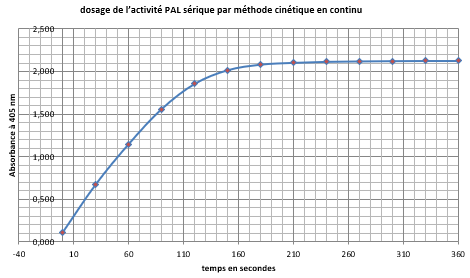
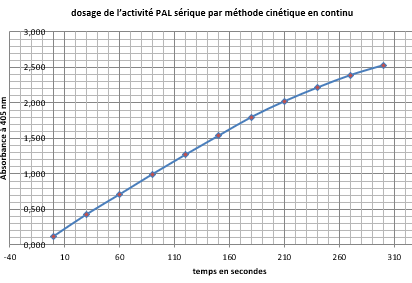
- Suivre l'évolution de l'absorbance en continu sur cinq minutes :
- Soit sur l’écran du PC relié au spectrophotomètre (puis exporter la courbe sur clé USB).
- Soit relever l’absorbance toutes les 30 secondes.
Exemples d'indications d'absorbance relevées toutes les 30 secondes (2021) :
| 0 |
30 |
60 |
90 |
120 |
150 |
180 |
210 |
240 |
270 |
300 |
330 |
360 |
| 0,090 |
0,407 |
0,685 |
0,954 |
1,206 |
1,430 |
1,619 |
1,713 |
1,869 |
1,932 |
1,975 |
2,000 |
2,015 |
Tracer le nuage de points : Aà 340 nm contre blanc réactif = f(temps en secondes).
Titrer et légender.
 Bonjour,
Bonjour,