- Présenter le principe de ce test.
- Indiquer ce que le test Pastorex Staph Plus permet de rechercher.
- Schématiser, au niveau moléculaire et à l'aide de la légende du document 3, l'édifice moléculaire aboutissant à la formation d'un agglutinat visible à l'œil nu (cas d'un test positif).
- Schématiser le résultat de chacun des deux tests (témoin et essai).

Comparaison de deux tests d'agglutination de fabricants différents
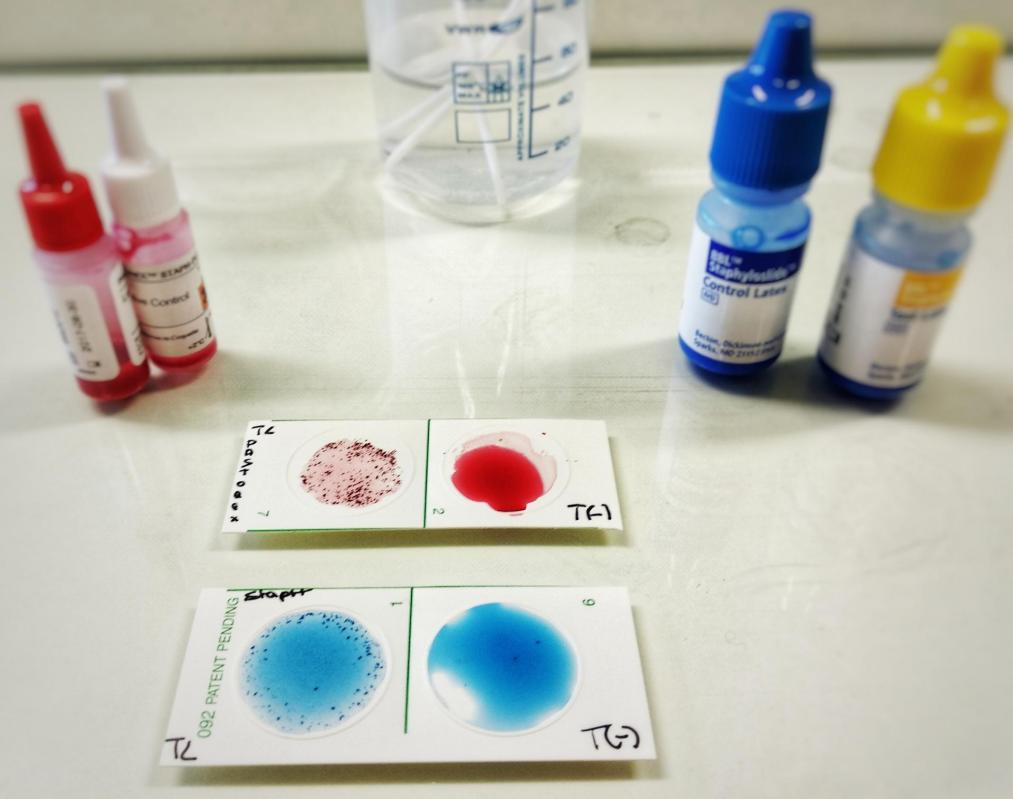
- Résumer tous les caractères morphologiques, culturaux et biochimiques de la souche étudiée et confirmer (ou infirmer) son appartenance à l'espèce aureus
g) Recherche de la thermonucléase pour détermination du caractère entérotoxique de la souche préalablement identifiée

- Indiquer quel est le lien entre entérotoxine staphylococcique et thermonucléase.
- Recherche de l'entérotoxine : schématiser, en utilisant les légendes proposées dans le document 1, l'assemblage moléculaire à la fin de la dernière étape de la recherche de l'entérotoxine par la technique immuno-enzymatique dans le cas d'un témoin positif
- Recherche de la thermonucléase
-Schématiser l'aspect de chaque test effectué, interpréter et conclure.
-Proposer la réalisation de témoins (positif et négatif) qui auraient dû être réalisés.
- Conclure sur le caractère entérotoxique de la souche testée.
Détermination du profil de sensibilité de la souche étudiée vis à vis de différents antibiotiques par la technique de l'antibiogramme standard



- Rédiger un schéma légendé de la gélose après l'incubation incluant : disque d'antibiotique, zone d'inhibition de culture, culture, zone correspondant à la concentration minimale inhibitrice.
- Reproduire et compléter le tableau suivant
- Indiquer quel(s) antibiotique(s) choisir pour traiter le patient.

Détermination du la concentration minimale inhibitrice de la ceftriaxone sur S. aureus par dilution en milieu liquide
Préparation de l’inoculum bactérien :
À partir d'une culture pure de 18 h (isolement sur GNO) :
-Préparer une suspension en eau physiologique équivalente à un étalon 0.5 Mc Farland
-Introduire 200 µL de cette suspension dans 25 mL de bouillon Mueller-Hinton
-Distribuer 1 mL dans 16 tubes à hémolyse è tubes notés INO.
Réalisation des dilutions en série de la solution d'antibiotique (1 plaque par binôme)
-Déposer 100 µL de milieu Mueller-Hinton dans les puits 1 à 12.
-Déposer 100 µL d'antibiotique Ceftriaxone à 2,5 mg.mL-1 dans le puits 1
-Après aspiration-refoulement, prélever 100 µL du puits 1 et les introduire dans le puits 2.
-Répé"ter l'opération jusqu'au puits 11.
-Prélevler 100 µL du puits 11, les jeter dans l'eau de Javel
-Déposer 100 µL d'inoculum bactérien dans les puits 1 à 12.
-Incubaer 18 h à 37 °C après avoir fermé hermétiquement les puits.
Vue d'ensemble :

Vue détaillée des puits 8 à 12 après 18 h d'incubation à 37 °C :


Détermination de la CMI en milieu liquide : pour l’antibiotique testé, résumer sous forme de tableau les informations suivantes :
- Les volumes de milieu Mueller-Hinton dans chaque cupule
- Le volume de solution d'antibiotique introduit dans la cupule 1.
- Le volume transféré entre chaque cupule
- La concentration intermédiaire en antibiotique exprimée en µg.mL-1 dans chaque tube
- Le volume d'inoculum bactérien introduit dans chaque cupule
- La concentration finale en antibiotique exprimée en µg.mL-1 dans chaque tube
- La présence (+) ou l’absence (-) de culture dans chaque cupule
- En déduire la CMI de la ceftriaxone sur la souche testée.
- Indiquer si la bactérie étudiée est sensible, intermédiaire ou résistante à cet antibiotique en utilisant les donnes fournies.
Présentation de l’antibiotique Ceftrixaone
La ceftriaxone est un antibiotique de la famille des bêtalactamines du groupe des céphalosporines de 3ème génération : c’est une céphalosporine semi-synthétique à très large spectre d'action et résistante aux bêtalactamases.