Objectifs :
- vérifier que la PAL est bien une enzyme michaelienne
- comparer l’efficacité de la PAL placée dans différentes conditions expérimentales.
La PAL (phosphatase) est une hydrolase, enzyme catalysant l’hydrolyse d’une liaison ester phosphorique sur de nombreux substrats en milieu alcalin (pH optimal où l’activité de l’enzyme est maximale) ; on choisit en général le substrat pNPP :
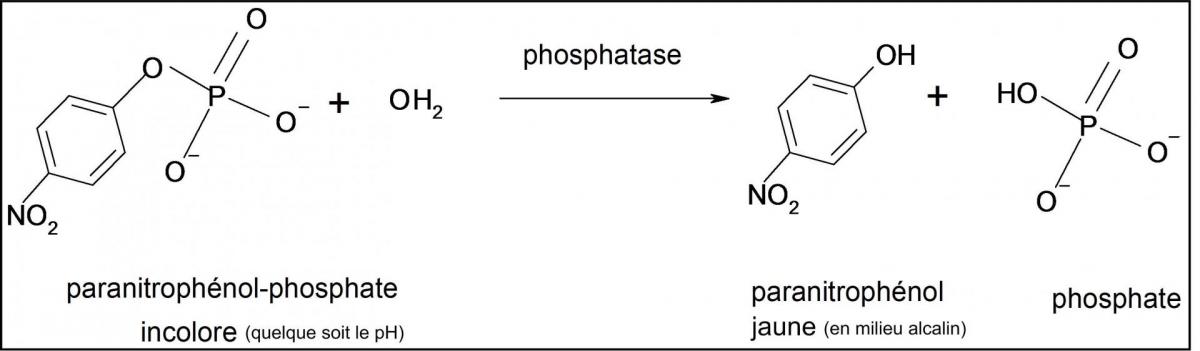

C'est une enzyme dite michaelienne : un substrat S se lie avec l'enzyme E pour donner un intermédiaire ES, qui se dissocie pour donner un produit P avec régénération de l'enzyme E.
C'est la concentration du substrat qui détermine l'action de l'enzyme michaelienne : plus grande est la concentration, plus la modification de la molécule est importante.
Pour vérifier que la PAL est une enzyma michaelienne, on dispose de deux grandeurs (ou constantes cinétiques) :
vi max ou vitesse initiale volumique de réaction (vi) maximale : quantité de produit apparu (ou de substrat disparu) par volume de milieu réactionnel (MR) et par unité de temps, pour une concentration initiale en substrat très élevée, à pH et température constants et proches des valeurs optimales de fonctionnement de l’enzyme.
- c(pNPP ; sol. pNPP) à t0 = concentration en substrat dans le milieu réactionnel au temps 0.
- c(pNPP ; sol. pNPP) à t0 est très élevée si le substrat est saturant pour l’enzyme (c(pNPP ; sol. pNPP) à t0 > 10 x KM).
KM ou constante de Michaelis : c'est l’inverse de l’affinité de l’enzyme pour le substrat : plus KM est petit, plus l’affinité est grande. C’est aussi la concentration en substrat placé dans le milieu réactionnel avant le début de la réaction ([S0]) pour laquelle on obtient vi = vimax / 2.
Pour déterminer ces deux paramètres, il faut :
- étudier la réaction enzymatique pour différentes concentrations en substrat initial ;
- tracer la courbe vi = f (c(pNPP ; sol. pNPP) à t0 ).
Remarque : des informations complémentaires sont disponibles sur ce site : http://biotech.spip.ac-rouen.fr/spip.php?article18
1ère partie : réalisation d'une gamme de substrat de concentration croissante
Pipetage (autorisé dans le flacon : petit volume et évite un transfert en bécher) d'une solution de substrat para-nitrophénol phosphate (pNPP) :

2ème partie : détermination des constantes cinétiques KM et vimax de la PAL en présence du substrat pNPP
À partir des dilutions du pNPP du protocole 1, préparer les microcuves (1 mL) suivantes :
|
Tubes
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Dilution du substrat à utiliser
|
/
|
1/16
|
1/8
|
1/4
|
1/3
|
1/2
|
2/3
|
1
|
|
Solution de pNPP dilué (mL)
|
0
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
|
Tampon DEA pH 9,8 (mL)
|
0,8
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
|
Pré-incuber 5 min à 37 °C.
|
|
Ajouter au temps t (en min)
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Solution de PAL (mL)
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
|
Agiter après chaque addition et remettre à 37 °C.
|
|
Ajouter au temps t (en min)
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
|
NaOH à 2 mol·L-1 (mL)
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
Mesurer les absorbances à 405 nm contre le tube 0.
3ème partie : détermination des constantes cinétiques KM et vimax de la PAL en présence du substrat pNPP et d'un effecteur Na2HPO4
À partir des dilutions du pNPP du protocole 1, préparer les microcuves (1 mL) suivantes :
|
Tubes
|
A
|
B
|
C
|
D
|
E
|
F
|
G
|
H
|
|
Dilution du substrat
|
/
|
1/16
|
1/8
|
1/4
|
1/3
|
1/2
|
2/3
|
1
|
|
Solution de pNPP dilué (mL)
|
0
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
|
Tampon DEA pH 9,8 (mL)
|
0,4
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Solution d’effecteur Na2HPO4 (mL)
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
|
Pré-incuber 5 min à 37 °C.
|
|
Ajouter au temps t (en min)
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Solution de PAL (mL)
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
|
Agiter après chaque addition et remettre à 37 °C.
|
|
Ajouter au temps t (en min )
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
|
NaOH à 2 mol·L-1 (mL)
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
0,4
|
Mesurer les absorbances à 405 nm contre le tube A.
4ème partie : exploitation des valeurs mesurées
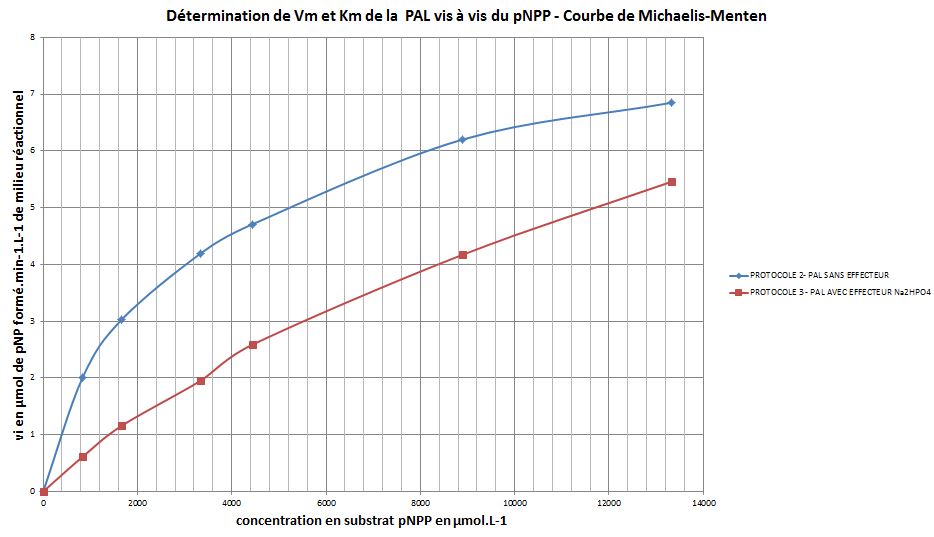
- Pour chacune des deux conditions expériméntales, tracer sur un même graphe, à l’aide du tableur, la courbe de Michaelis-Menten :
vi (en µmole de pNP.min-1.L-1 de milieu réactionnel) = f (cpNPP en µmol.L-1 de MR)
- Commenter l’aspect de la courbe et sa signification.
- Déterminer les constantes cinétiques KM et Vimax de la PAL vis-à-vis du pNPP en absence et en présence de l'effecteur.
- Cette détermination est-elle possible, sans ambiguité ? Si non, expliquer pourquoi, et estimer de façon approximative Vm et Km dans chacun des deux protocoles.
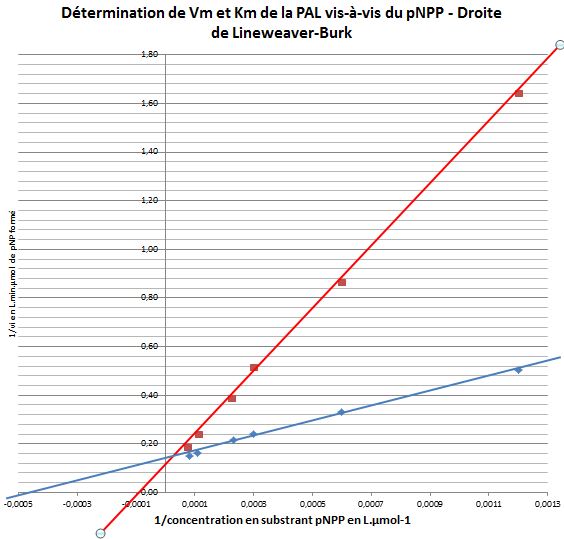
- Pour chacune des deux conditions expériméntales, tracer sur un même graphe, à l’aide du tableur, la représentation en double inverse (dite de Lineweaver-Burk) :
1/vi (en min.L de milieu réactionnel.µmole-1 de pNP) = f(1/cpNPP en L de MR.mol-1).
- Déterminer les constantes cinétiques KM et Vimax de la PAL vis-à-vis du pNPP en absence et en présence de l'effecteur.
- Cette détermination est-elle possible, sans ambiguité ?
- Reproduire et compléter les tableaux suivants :
|
|
Avec vi = f (cpNPP)
|
Avec 1/vi = f (1/cpNPP)
|
|
|
KM
|
vimax
|
1/Km
|
1/ vimax
|
KM
|
vimax
|
|
PAL &
pNPP
|
|
|
|
|
|
|
|
µmol·L-1
|
µmol·min-1·L-1
|
L·µmol-1
|
L·min·µmol-1
|
µmol·L-1
|
µmol·min-1·L-1
|
|
Avec vi = f (cpNPP)
|
Avec 1/vi = f (1/cpNPP)
|
|
|
KM
|
vimax
|
1/Km
|
1/ vimax
|
KM
|
vimax
|
|
PAL, pNPP &
effecteur
|
|
|
|
|
|
|
|
µmol·L-1
|
µmol·min-1·L-1
|
L·µmol-1
|
L·min·µmol-1
|
µmol·L-1
|
µmol·min-1·L-1
|
- Identifier le type d’inhibition exercée par l’effecteur testé
L'exploitation de cette activité se fait sur tableur-grapheur (Excel, Calc...).
Afin de gagner du temps, je fournis aux élèves un tableur contenant :
- le tableau avec les noms et unités des grandeurs d'entrée à saisir et des grandeurs de sortie à calculer (facile à réaliser mais ici inutilement long)
- les deux zones de graaphique déjà légendées, avec des échelles d'axes adaptées à nos conditions expérimentales.
Les élèves sont donc chargés de rédiger les formules dans chaque cellule, ce qui développe :
- la compréhension des calculs à réaliser (dilutions mises en oeuvre, volumes impliqués, vitesses initiale volumique, conversions d'unités....)
- des notions d'algorithmique.
LIEN VERS LE TABLEUR A COMPLETER DE CETTE ACTIVITE
LIEN VERS LE TABLEUR DE CETTE ACTIVITE