Objectif : extraire une enzyme microbienne (l’invertase des cellules de levure) et déterminer la concentration d’activité catalytique de cette enzyme par la méthode deux points
- L’extraction sera obtenue par passage au mixer des cellules de levure.
- La purification sera réalisée simplement par une autolyse du broyat obtenu durant 24 h à 40 °C.
- L’évolution de la purification est suivie par la détermination du rendement de la purification et par la mesure de l’enrichissement ou taux de purification.
L'invertase (= β-D-fructosidase = saccharase) ou β-D-Fructofuranoside Fructohydrolase (EC : 3.2.1.26) est une enzyme qui catalyse l’hydrolyse du saccharose en glucose et fructose. Dans l’industrie agro-alimentaire, elle utilisée comme additif alimentaire (connue sous le nom d’agent stabilisant E1103) car elle évite la cristallisation du sucre notamment dans la confection des confiseries.
D’origine naturelle, elle est synthétisée par la levure de boulangerie Saccharomyces cerevisiae. Elle est présente sous deux formes :
|
INVERTASE EXTERNE
|
INVERTASE INTERNE
|
|
Forme prédominante dans la paroi (pariétale)
|
Forme minoritaire dans le cytoplasme et la vacuole
|
|
Minvertase pariétale = 270 000 g·mol-1 (soit 270 kDa)
|
Minvertase intracellulaire = 135 000 g·mol-1 (soit 137 kDa)
|
|
Constituée de 50 % de protéine et de 50 % de glucides, non indispensables à l'activité catalytique mais augmentent la stabilité de l’enzyme
|
Il n'y a pas de partie glucidique
|
Réaction catalysée par l’invertase :
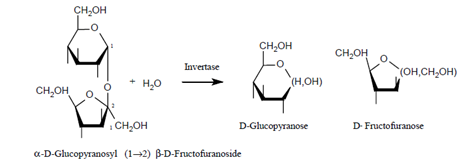
Au cours de l’hydrolyse, on passe d’une solution de saccharose (glucide non réducteur) de pouvoir rotatoire positif, à une solution de glucose et fructose (deux oses réducteurs) de pouvoir rotatoire négatif ; c’est pourquoi on appelle la solution finale "solution de GLUCIDES INVERTIS".
1ère partie : extraction et dosage de l'activité invertase de la levure
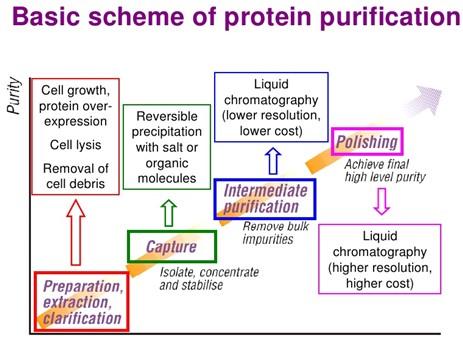
Les étapes de purification d'une protéine
La purification d'une protéine est un processus qui prend plusieurs étapes : extraction initiale, précipitation différentielle, dialyse, chromatographies de divers types, etc.
- Typiquement, on broie tout d'abord le matériel d'où on veut extraire la protéine (tissu animal, partie de plantes, bactéries, etc.). Cette homogénéisation se fait dans un tampon approprié.
Si la protéine est dans un compartiment cellulaire, on utilise généralement un détergent doux (Triton, Tween, etc., quelquefois du désoxycholate) pour la libérer en dissolvant les membranes de ce compartiment. L'emploi de détergent doit souvent être fait de façon contrôlée car ils peuvent briser les lysosomes, ce qui libère des enzymes hydrolytiques (protéases, nucléases) qui peuvent attaquer et détruire les protéines ou autres molécules qu'on veut isoler. Une solution à ce problème est l'inclusion dans les solutions d'inhibiteurs de protéases.
- L'homogénat ainsi obtenu est ensuite clarifié, le plus souvent par centrifugation, pour éliminer les grosses particules peu ou mal broyées ou encore pour obtenir la fraction cellulaire contenant la protéine recherchée.
- Puis on utilise diverses techniques pour séparer la protéine recherchée des autres protéines.
- Les premières étapes sont des techniques peu spécifiques (précipitation différentielle au sulfate d'ammonium).
Ensuite, on utilise des techniques de plus en plus spécifiques (chromatographies d'échange ionique ou chromatographies d`affinité).
- Enfin, on utilise le tamisage moléculaire (gel-filtration) ou l'isofocalisation qui permettent d'augmenter la pureté, mais aboutissent à de petits volumes de protéines concentrées.
- Souvent, entre ces étapes, il faut éliminer les sels ou produits utilisés dans ces chromatographies. On utilise alors une dialyse ou une ultrafiltration. Si on a besoin de concentrer la préparation, on la lyophilise. Si on veut éviter ces procédures, on doit choisir des méthodes qui ne sont pas affectées négativement par ces produits
À l’aide des informations du contexte et des documents 1, 2 et 3, répondre aux questions :
- Résumer sous forme de logigramme les grandes étapes de la purification d'une protéine.
- Proposer une explication sur le nom donné à cette enzyme : invertase.
- Justifier les traitements (document 1 : broyage, autolyse) pour obtenir de l'invertase.
- Comparer la réalisation de l’homogénat H et de l’autolysat A puis proposer une justification à la préparation de l’autolysat A.
- Reproduire et compléter le tableau du document 2. Justifier les calculs.
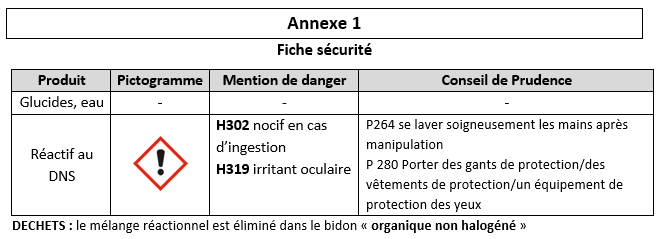
- Évaluer les risques liés aux manipulations à l’aide de l’annexe 1.
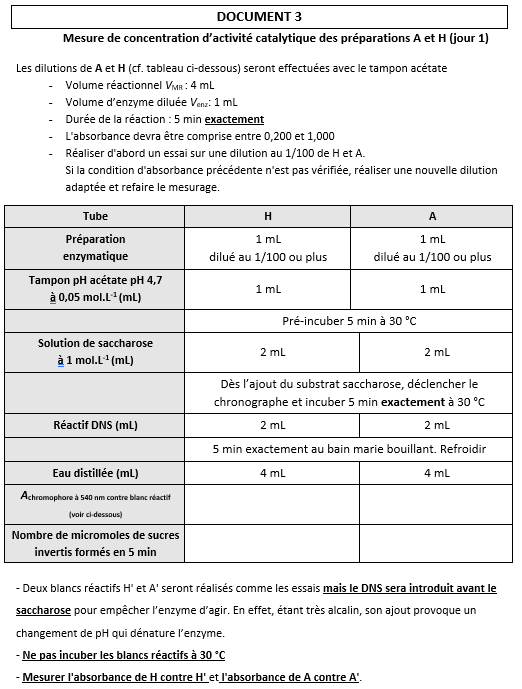
- Justifier la nécessité de la pré-incubation durant environ 5 minutes.
- Justifier la nécessité de respecter une durée d’incubation exacte de 5 minutes.
- Identifier le réactif d’arrêt utilisé pour stopper l’action de l’invertase.
Relever les deux effets de ce réactif.
- Justifier l’ordre d’introduction des constituants du mélange dans la réalisation des blancs réactifs A' et H'.